

ESTUDIO ETOLOGICO DEL PICHICO BARBA BLANCA, Saguinus mystax mystax Y DEL PICHICO COMUN, Saguinus fuscicollis nigrifrons (PRIMATES;CALLITRICHIDAE) EN UN GALPÓN AL AIRE LIBRE - RESULTADOS PRELIMINARES.
Eckhard W. Heymann y Luis A. Sicchar
INTRODUCCIÓN
En los últimos años, varios estudios de campo han sido ejecutados en la Amazonía Peruana sobre la ecología y dinámica poblacional del pichico barba blanca, Saguinus mystax, y del pichico común, Saguinus fuscicollis (Castro y Soini 1977; Garber 1986, en prensa; Garber y Teaford 1986; Garber et al. 1984; Gazzo, este volumen; Clander et al. 1984; Moya et al., este volumen; Ramírez 1983, 1984a, 1984b, 1985a, 1985b; Soini, este volumen; Soini y Soini, este volumen). Sin embargo, aspectos del comportamiento y de la comunicación del pichico común solamente han sido estudiados en el laboratorio (Cebul y Epple 1984; Epple 1972, 1978; Epple y Katz 1980, Moody 1978, Moody y Menzel 1976; Vogt 1978a, 1978b; Vogt: et al. 1978). Con respecto al pichico barba blanca, dos estudios preliminares han sido realizados hasta ahora (Box y Morris 1980, Kaumanns, 1982).
En medio natural, el estudio de los detalles del comportamiento y de la comunicación de primates por regla general es muy difícil, particularmente en animales arbóreos y tan pequeños como los pichicos. Por otro lado, estudios en el laboratorio pueden ser de valor limitado debido al medio restringido. En esta situación, estudios en galpones al aire libre son muy ventajosos, porque forman un ambiente más natural que la jaula en el laboratorio y hacen factible una mayor proximidad y, por ende, mejor posibilidad de observar que en el campo.
En este trabajo presentamos algunos resultados obtenidos en dos estudios sobre el comportamiento y la comunicación del pichico barba blanca y pichico común en el galpón de reproducción al aire libre (GRAL) del Centro de Reproducción y Conservación de Primates, No Humanos (CRCP) en Iquitos (Perú), entre Noviembre 1981 y Marzo 1983. Información cualitativa adicional fue obtenida durante visitas rutinarias al GRAL entre 1983 y 1986.
MATERIALES Y MÉTODOS
El galpón al aire libre
El galpón está construido de madera redonda (horcones) y aserrada (listones). Tiene 13 m de longitud, 9 m de ancho y 2,5 m de alto, cubierto por malla metálica tipo mosquitero. En su interior presenta un sistema de perchas de palos redondos, dispuestos horizontal, diagonal y verticalmente. El techo formado por listones de madera en forma de parrilla, descansa sobre soleras (maderas redondas horizontales que descansan sobre los horcones periféricos e internos). Las perchas dispuestas interiormente están sujetas a las soleras por su parte apical y sus bases sobre soportes transversales de madera redonda (Fig. D. Además, en los lados derecho e izquierdo cerca del extremo posterior presenta 2 "ventanas" de malla de alambre de 1 pulgada de cocada para facilitar el ingreso de insectos al interior, donde se desarrolla vegetación arbustiva y herbácea para posibilitar el desarrollo de los mismos. También presenta en los mismos lados 2 jaulas de malla metálica de igual característica, donde se alberga un nidal para el descanso nocturno. En estas jaulas se les proporciona el alimento a los animales. En el extremo anterior interno se ubica una banca de madera (asiento del observador). De este extremo se puede observar todo el galpón. Exteriormente, por los lados izquierdo y anterior, está protegido por una cerca de hojas de palmera, y por los lados posterior y derecho está protegido por vegetación.

Los animales
Los estudios comenzaron en Noviembre 1981, con la introducción de una pareja de Saguinus mystax y otra de Saguinus fuscicollis de origen silvestre (Kaumanns 1982). El macho S. mystax y los dos S. fuscicollis murieron en Enero 1982. En Abril 1982, fueron introducidos un macho adulto S. mystax y otra pareja S. fuscicollis procedentes de campo. En Enero 1983, la hembra S. fuscicollis dio a luz a sus mellizos. Desde entonces ha tenido tres camadas más, en Octubre 1983, Mayo 1985 y Julio 1986. El macho de S. mystax fue probablemente estéril, y por eso fue reemplazado por otro macho en Abril 1983. En Agosto 1983, la hembra S. mystax dio a luz a su primera camada. Posteriormente tuvo camadas adicionales, en julio 1984, junio 1985 y Julio 1986. Una de las crías de la primera camada de S. mystax murió en un accidente y la segunda camada murió debido a problemas de lactancia por parte de la madre. Un S. fuíscicollis escapó del galpón en Mayo 1986. El resto de los animales continuó en el galpón.
Colección de datos
Se realizaron aproximadamente 700 horas de observación en el galpón al aire libre, entre Noviembre 1981 y Marzo 1983. Los datos tomados fueron sus vocalizaciones, marcaciones olfatorias, uso del espacio, interacciones sociales (intraespecíficas e interespecíficas), cuidado de las crías y comportamiento alimenticio. Los detalles de los métodos de toma de datos son descritos a continuación:
Vocalizaciones.
Las vocalizaciones fueron grabadas con un magnetófono estéreo Uher 4200, con un micrófono direccional Sennheiser MKH 816 y un micrófono Sennheiser MD 411. La velocidad del magnetófono estaba puesta a 19 cm/S.
Marcaciones olfatorias. Se aplicó el método de "all occurrences-sampling" (Altmann 1974) para la toma de datos sobre marcaciones olfatorias y el comportamiento asociado (olfatear, lamer, frotar el hocico, etc.). En cada registro, se anotaron el individuo, tipo de comportamiento, hora y posición espacial del animal.
Relaciones espaciales.
Para tomar datos de las relaciones espaciales se utilizó un croquis en escala del galpón. La posición de cada individuo fue registrada al principio de cada minuto ("scan-samplig", Altmann 1974).
Interacciones sociales.
Todas las interacciones sociales intraespecíficas e interespecífueron registradasanotando los individuos que participabanel tipo de interacción la hora y posició espacial. En caso del despioje socialse registró tiempo duración.
Cuidado de las crías.
Cuando nació la primera camada de S. fuscicollis, se tomaron datos cada 5 minutos sobre quién cargaba las crías o si éstas andaban independientemente. Otros comportamientos dirigidos a las crías (amamantar, lamer, cambio de las crías de un cargador a otro, rechazo de la cría, etc.) fueron registrados siguiendo el método de "all occurrences-sampling" (Altmann 1974).
Busca y caza de insectos.
Se llevaron registros cualitativos de las técnicas de
búsqueda de insectos y de las circunstancias de comportamiento predatorio.
RESULTADOS
Vocalización
Todos los Callitrícidos estudiados hasta ahora emplean una amplia variedad de vocalizaciones (p. ej. Cebuella pygmaea: Pola y Snowdon 1975; Callithrlx jacchus: Epple 1968; Winters y Rothe 1979; Callithrix argentata: Omedes 1983, 1984; Saguinus fuscicollis: Moody 1978, Moody y Menzel 1976; Saguinus oedipus: Cleveland y Snowdon 1982, Goedeking 1983, Muckenhirn 1967; Leontopithecus rosalia: McLanahan y Green 1977). Poco se sabe del repertorio vocal de Saguinus mystax; por tal motivo, las vocalizaciones del pichico barba blanca fueron grabadas en el galpón al aire libre y analizadas con un sonógrafo en el laboratorio. La vocalización más llamativa de Saguinus mystax es la "vocalización larga" ("Long call"), anteriormente llamada "vocalización de larga distancia". Este último nombre fue abandonado porque tiene interpretación funcional: es más útil designar las vocalizaciones según aspectos sintácticos (Tembrock 1975)
La Fig. 2 ilustra sonogramas de cuatro vocalizaciones largas. Las siguientes características de la estructura física son evidentes:
- Vocalizaciones largas son compuestas de sucesiones de sonidos individuales (elementos)
- La duración de los elementos crece continuamente hasta el fin de la vocalización larga;
- Los elementos son tonales y modulados en la frecuencia;
- La dimensión de la modulación de la frecuencia cambia durante el curso de la vocalización larga.

Fig. 2.-Sonogramas de vocalizaciones largas
de Saguinus mystax (a),(b) Macho; (c), (d) Hembra.
Como se puede apreciar en los sonogramas, las vocalizaciones largas son distintas en el macho y en la hembra. Las diferencias corresponden a la duración total de las vocalizaciones largas, a la duración de los elementos, al número de elementos por período, a la frecuencia inicial y la frecuencia máxima de los elementos.
Esto sugiere la existencia de diferencias individuales en la estructura física de las vocalizaciones largas. Esta suposición está reforzada por la comparación con sonogramas de vocalizaciones largas grabadas de otros pichicos barba blanca en el CRCP y en medio natural; como también por resultados de unos experimentos de playback realizados en el GRAL, que provocaron reacciones diferentes de playback de una vocalización larga de la hembra del GRAL y de una vocalización larga de un pichico barba blanca desconocido al macho y a la hembra. Estos resultados están de conformidad con aquellos de Snowdon y Hodun (1985) que también indican diferencias individuales en la estructura física de vocalizaciones largas.
La Fig. 3 muestra ejemplos de otras vocalizaciones de pichicos barba blanca. Estas vocalizaciones representadas por los sonogramas de Fig. 3a-c son emitidas durante la búsqueda de insectos, descanso o agitación ligera. Este sonograma solamente muestra una selección de la variedad de vocalizaciones asociadas con estas categorías de comportamiento. Todas estas vocalizaciones son sonidos individuales con modulación de frecuencia. La Fig. 3d exhibe un sonograma de una vocalización que los pichicos emiten cuando están ingiriendo particularmente una comida preferida. Las vocalizaciones representadas por el sonograma de la Fig. 3e se dieron cuando un ave de rapiña sobrevolaba al GRAL. Estas vocalizaciones pueden ser emitidas individualmente o en sucesión. La Fig. 3f muestra vocalizaciones que son emitidas cuando los pichicos son molestados por una persona foránea o ruidos altos. La
Fig. 3g muestra un chillido. Los chillidos son emitidos cuando los animales están siendo manipulados. Gritos (Fig. 3h) son emitidos cuando un animal pide al otro por una comida preferida. Algunas de las vocalizaciones mostradas en Fig. 3 asemejan a las de pichicos barriga anaranjada, Saguinus labiatus (Coates y Poole 1983). Esta similitud puede ser debido a la cercana relación filogenética entre el pichico barba blanca y el pichico barriga anaranjada (Hershkovitz 1977). La compilación de las vocalizaciones presentadas aquí no representa el repertorio vocal completo del pichico barba blanca. Otras vocalizaciones son sonidos individuales, sucesiones de sonidos o vocalizaciones compuestas (o sea combinación de dos o más sonidos diferentes). Una descripción más detallada de las vocalizaciones de S. mystax será presentada por Heymann (1985).
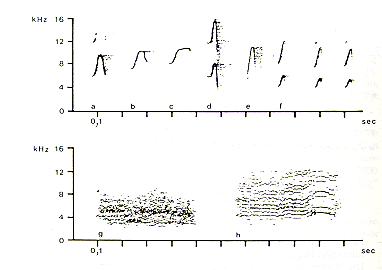
Fig. 3.- Sonogramas de algunas vocalizaciones de Saguinus mystax.
Marcaciones olfatorias y comportamiento asociado
Las marcaciones olfatorias con secreciones de glándulas cutáneas especializadas, es un comportamiento común en todos los Callitrícidos estudiados hasta ahora (para una sinopsis, ver Epple 1972, 1985).
En el GRAL, observamos que los pichicos barba blanca ejecutan marcaciones . 1 anogenitales (Fig. 4), suprapúbicas y esternales. Las marcaciones anogenitales fueron las más frecuentes, representando el 92% de todas las marcaciones observadas. Las marcaciones suprapúbicas y esternales fueron escasas (5% y 3%). Acciones similares fueron observadas en S. labiatus por Coates y Poole (1983). La frecuencia de marcaciones anogenitales fue tres veces más alta en la hembra que en el macho, pero marcaciones esternales fueron observadas raramente y marcaciones suprapúbicas nunca en la hembra. También en los otros Callitrícidos, las hembras exhiben más marcaciones anogenitales que los machos (S. labiatus: Coates y Poole 1983; S. oedipus: French y Cleveland 1984; Wolters 1978). La micción fue asociada frecuentemente con marcaciones olfatorias, particularmente en la hembra. Generalmente sueltan algunas gotas de orina antes, durante o después de la marcación, pero a veces también son eliminadas grandes cantidades. El orinar a la mano es un comportamiento observado sólo en el pichico barba blanca y descrito por primera vez en una especie de Calitrícido (Heymann et al. 1985). Es probable que se trate de una forma "incompleta" de "urine washing" ("lavar con orina"), un comportamiento conocido por ejemplo en frailes, Saimiri sciureus. No se conoce la función del orinar a la mano, puede estar relacionado con las marcaciones olfatorias, o los lugares donde un animal frecuentemente olfatea. A veces, la hembra S. mystax restrega las mejillas en puntos de orina del macho; este comportamiento probablemente es un tipo de auto-impregnación.

Fig. 4 .- Marcación anogenital en Saguinus mystax
El frotar el hocico es un comportamiento no solamente asociado con el comer, sino también con marcaciones olfatorias, que podría ser demostrado con análisis estadísticos multivariados. La distribución temporal y espacial del frotar el hocico está relacionada con las distribuciones temporales y espaciales de marcaciones olfatorias y micción en el pichico barba blanca (Heymann y Schwibbe, en prep.). La hembra de S. mystax exhibe fluctuaciones a largo plazo de las frecuencias del frotar el hocico, que posiblemente son correlacionadas con el ciclo de estro (Heymann y Schwibbe, en prep.). No se sabe si el frotar el hocico es una manera de marcar o una manera de percibir olores.
Comportamiento espacial
Comprende la relación entre un animal y los factores animados (por ejemplo, compañeros) e inanimados (p. ej. topografía) de su ambiente (Wilson 1972). El análisis del comportamiento espacial puede ser aplicado a la descripción de estructuras sociales de una manada (p. ej. empleando las distancias interindividuales, Vogt 1978b); a la evaluación del uso del espacio por individuos o manadas (p. ej. calculando el tiempo pasado en diferentes partes del territorio, Dawson 1979); y a la descripción de ritmos diarios de actividad (p. ej. mediante las distancias recorridas por unidad de tiempo, Dawson 1979).
En este capítulo se presentan algunos ejemplos para la aplicación del análisis del comportamiento espacial en el estudio del comportamiento de pichicos barba blanca y de pichicos comunes en el GRAL.
Ritmo diario de actividad
El ritmo diario de actividad es analizado en términos
de distancias promedio recorridas por cada 15 minutos. Como se puede ver en
la Fig. 5, las distancias recorridas muestran una fluctuación durante
el día. Todos los individuos tienen su máximo en las mañanas
(antes de 07:30 h) y un segundo máximo por la tarde (entre 13:30 y 15:30
h). Generalmente, los pichicos barba blanca recorren distancias más largas
que los pichicos comunes. En la mañana (antes de 07:30 h) los machos
de S. mystax y S. fuscicollis recorren distancias más largas que sus
hembras respectivas.
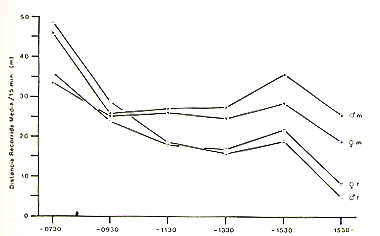
Fig. 5.- Ritmo de.actividad de Saguinus
mystax y
Saguinus fuscícollís.m: S. mystax, f: S. fuscicollis.
Estructura de grupo
Se calcularon las distancias promedio interindividuales para analizar la estructura de grupo en términos de dispersión espacial. La Fig. 6 muestra las distancias intraespecíficas. Dentro de las parejas, las distancias son mayores en la mañana, y exhiben un segundo pico a mediados de la tarde. La pareja de S. mystax mantiene distancias interindividuales mayores que la pareja de S. fuscicollis durante todo el día. Esto significa que la cohesión espacial es mayor en S. fuscicollis que en S. mystax. La Fig. 7 muestra las distancias interespecíficas. Las mayores distancias existen entre los dos machos, y las menores entre las dos hembras. La relación espacial que existe entre las dos hembras (despioje interespecífico, Heymann y Sicchar, en prep.), se refleja también en la relación espacial.
Uso del espacio
Existen diferentes parámetros para la evaluación del uso del espacio en primates (Rasmussen 1980; Schwibbe y Kaumanns, en prep.). Como un ejemplo, se presentan aquí los parámetros aplicados en el estudio de Sicchar (en prep.): La redundancia RED - 1 H/H máx, donde H significa el número de cuadrantes del GRAL ocupadas por unidad de tiempo y H máx el número total de cuadrantes. Como se puede ver en Fig. 8, la redundancia es menor a mediados de la tarde para los pichicos barba blanca y en la mañana para los pichicos comunes. Eso significa que los pichicos barba blanca usan el espacio disponible más intensivamente por la mañana. Análisis e interpretaciones biológicas adicionales serán presentadas (Sicchar, en prep.).
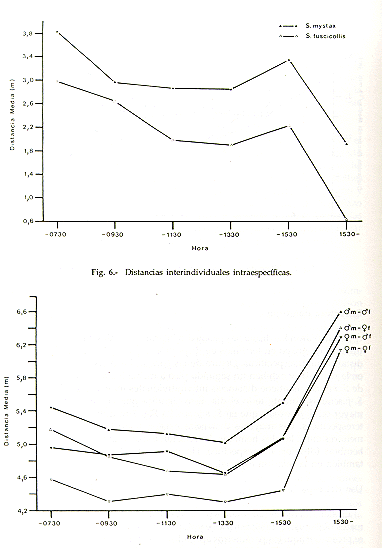
Fig. 7. - Distancias interindividuales
interespecíficas.
m: S. mystax, f: S. fuscicollis.
Comportamiento social
Como la mayoría de los primates, los Callitrícidos viven en manadas, o sea son animales sociales. Aunque la estructura social de los Callitrícidos es actualmente materia de discusión (Garber et al. 1984; Sussman y Garber, en prensa; Terborgh 1983, Terborgh y Goldizen 1985), poco se sabe sobre el comportamiento social dentro del género Saguinus. El despioje social (Fig. 9) es la interacción preponderante en los pichicos barba blanca y pichicos comunes. El Cuadro 1 exhibe algunos resultados preliminares de análisis sobre el despioje social en las dos parejas. En la pareja de pichicos barba blanca, la hembra muestra una frecuencia de despioje social más alta que el macho, pero la duración promedio de las sesiones de despioje es mayor en el macho. En la pareja de pichicos comunes, la frecuencia de despioje social es más alta en el macho, pero la duración es mayor en la hembra.
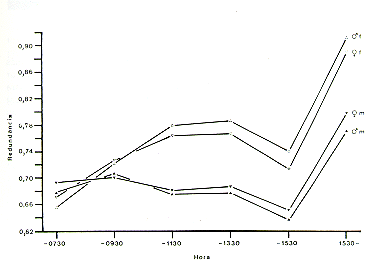
Fig. 8. - Redundancia del uso del espacio.
m: S. mystax, f: S. fuscicolli.
Sin embargo, las diferencias no son estadística mente
significativas. En ambas parejas, el macho pasa más tiempo despiojando
a la hembra que ésta al macho. (Es necesario considerar que estos datos
están basados solamente en 35,4 horas de observación para S. mystax
y 13,5 horas para S. fuscicollis; es decir el análisis del despioje social
todavía no está terminado).

Fig. 9. - Despioje en Sanguinus
mystax
Para S. mystax, nuestros datos no concuerdan con los de Box y Morris (1980), quienes hallaron que las hembras despiojaban más veces a los machos, que éstos a las hembras; pero están de acuerdo con los datos de Coates y Poole (1983) para S. labiatus, donde machos despiojaban a la hembra más veces que la hembra al macho. En una manada de S. fuscicollis illigeri, Vogt (1978a) observó que el macho adulto recibió más despioje que cualquier otro animal y la hembra adulta era la que más despiojaba. La relación de despioje entre estos dos individuos era más intensa que en el resto de los animales de la manada. Como en otros estudios etológicos en pichicos, se observó agresión dentro de las parejas. Solamente en los primeros días después del nacimiento de su primera camada, la hembra S. fuscicollis se mostraba agresiva hacia el macho cuando trató de tomar posesión de las crías. El juego social ocurría frecuentemente en la pareja de S. mystax, pero fue muy escaso en la pareja de S. fuscicollis. En los pichicos comunes, la frecuencia de juego social aumentó cuando las crías empezaron a tener locomoción independiente. El macho era mayormente quien jugaba con las crías. El olfatear al compañero, particularmente en la región anogenital, fue característica de los machos, pero raramente en las hembras. La monta y cópula fueron observadas pocas veces, pero parecía ser un poco más frecuente en S. fuscicollis que en S. mystax.
Cuadro 1.- Frecuencia y duración del despioje social.
| Saguinus mystax |
Saguinus fuscicollis |
|||
|
Macho |
Hembra |
Macho |
Hembra |
|
|
Número de sesiones de despioje por hora |
2,2 |
3,3 |
4,1 |
2,2 |
|
Duración media (seg) |
82,8 |
65,3 |
47,5 |
63,6 |
|
% de tiempo en despioje |
6,0 |
5,1 |
5,4 |
3,9 |
|
Tiempo de observación (horas) |
35,4 |
13,5 |
||
Cuidado de las crías
Cuando nació la primera camada de S. fuscicollis, el 14 de Enero 1983, se tomaron datos sobre el cuidado de las crías (Fig. 10) y el desarrollo de independencia de las crías durante las primeras 11 semanas de vida.
La Fig. 11 muestra las contribuciones del macho y la hembra al cargar las crías, y el desarrollo de independencia. Solamente en la primera semana después del nacimiento la hembra cargaba las crías más que el macho, después su contribución disminuyó hasta la quinta semana. La contribución del macho alcanzó el máximo en la tercera semana, luego disminuyó hasta la octava semana y cayó al nivel de los valores de la hembra en la undécima semana. Las crías fueron observadas salir por primera vez del cuerpo de los padres en la tercera semana. En la novena semana, las crías pasaban más tiempo moviéndose de un lado a otro por sí solas que cargadas por los padres. Estos resultados son similares a los observados en S. fuscicollis illigeri por Vogt et al. (1978), con la diferencia que en su estudio el padre cargaba las crías más veces que la hembra en la primera semana. La S. fuscicollis hembra era primípara (había sido capturada como adulta joven) y se comportó muy protectora con respecto a las crías. Posiblemente, las diferencias encontradas en cuanto a los resultados de Vogt: et al. (1978), eran debido a este comportamiento protector. No se tomaron datos cuantitativos sobre el cuidado de las crías en el pichico barba blanca. Sin embargo, las observaciones cualitativas indicaron que las crías eran cargadas mayormente por el padre.

Fig. 10. - Macho adulto de Sanguinus
fuscicollis cargando dos crías
de tres días de edad
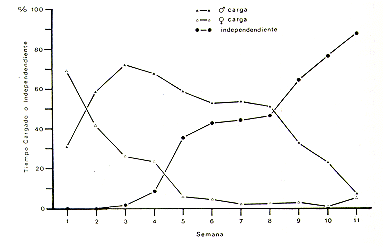
Fig. 11. - Contribución al cargar
de las crías y el desarrollo de independencia
Interacciones sociales interespecíficas
Donde viven en simpatría, el pichico barba blanca y el pichico común, frecuentemente forman manadas mixtas (Castro y Soini 1977; Garber y Teaford 1986; Heymann 1985; Ramírez 1984a, 1984b). Interacciones sociales entre individuos de las diferentes especies son muy escasas en medio natural y posiblemente están limitadas a interacciones agonísticas en árboles alimenticios Heymann 1985). En contraste con esto, varios tipos de interacciones sociales interespecíficas han sido observadas en el GRAL.
Despioje social
Despioje social interespecífico Fig. 12) ha sido observado frecuente en el GRAL (Heymann y Sicchar, en prep.). El aspecto más relevante del despioje social interespecífico era que solamente pichicos barba blanca despiojaban y solamente pichicos comunes recibían el despioje.

Fig. 12.- Hembra Saguínus mystax
despioja a hembra Saguínus fuscicollis.
Juego social
Los juveniles y subadultos, y a veces también los adultos, participaban en juego social interespecífico. La mayoría del comportamiento observado en el juego interespecífico, también se observó en el juego intraespecífico; cara de boca abierta, el mirar fijamente, protrusión de lengua, correr de un lado para otro, perseguir, luchar, ocultarse y montar. Las sesiones interespecíficas generalmente duraban menos tiempo que las sesiones de juego intraespecífico.
Pedir
El pedir comida a los adultos es un comportamiento intraespecífico muy común en los infantes y juveniles. A veces fue observado entre individuos de diferentes especies (Fig. 13). Contrastando con el pedir intraespecífico, el pedir interespecífico nunca resultó en la repartición de comida.
Interacciones agonísticas
Interacciones agonísticas eran acontecimientos escasos. Los siguientes tipos de interacciones han sido observados: mirar fijamente, amenazar con boca abierta, pegar, morder, manotear y perseguir. Contactos directos eran extremadamente escasos. Los pichicos barba blanca siempre eran los "ganadores" de las interacciones agonísticas interespecíficas

Fig. 13.- Hembra Saguinus mystax (derecha)
mendiga por comida a la hembra
Saguinus fuscicollis
Intentos de cópula
Algunos intentos de cópula entre individuos de diferentes especies fueron
observados; en todos los casos un subadulto S. fuscicollis trataba de
copular con un S. mystax. Generalmente estos intentos eran dirigidos
a pichicos barba blanca juveniles; sin embargo, se observó dos intentos
dirigidos a la hembra adulta durante la última fase de su preñez,
en junio 1985. No fue posible establecer si la motivación en estos dos
casos era sexual o de juego.
Busca y caza de insectos
Debido a las condiciones favorables dentro del GRAL y a la disponibilidad de una variedad de insectos, los pichicos podían pasar mucho tiempo cada día buscando y cazando insectos. Los pichicos buscaban insectos, volteando hojas (Fig. 14), mirando en huecos de los palos, etc. Los insectos capturados eran mayormente muy pequeños y no podían ser identificados por los observadores; pero también capturaban y comían muchos saltamontes y mariposas.

Fig. 14 .- Saguínus mystaxbuscando
insectos.
A veces comían arácnidos, pero nunca fueron vistos consumir coleópteros. Las presas preferidas eran las lagartijas pequeñas (Fig. 15). La primera parte que comían de la lagartija era siempre la cabeza. De esta observación parece que la primera mordedura que mata a la presa era dirigida a la cabeza craniocervical "killing bite" King y Steklis 1984, Steklis y King 1978). Cuando comían lagartijas, los pichicos barba blanca siempre emitían vocalizaciones como las representadas en el sonograma de la Fig. 3d. Luego, su compañero generalmente se acercaba y mendigaba por comida, pero esto nunca resultaba en repartición de la comida.

15.- Saguinus mistax comiendo una lagartija.
Las técnicas de caza de insectos usadas por los pichicos en el GRAL eran esencialmente las mismas observadas en el medio natural (Heymann, observ. personal). Los insectos y lagartijas consumidos parecían constituir una parte esencial del consumo diario de alimento. Kaunianns (1982) estimó que los insectos y otra presa comprendían por lo menos un tercio de la dicta. Es muy probable que este suplemento a la dicta contribuya muy esencialmente al buen estado de salud y al éxito de reproducción de ambas especies en el GRAL.
El galpón al aire libre (GRAL) del CRCP como un instrumento para estudios etológicos y de reproducción de pichicos.
Los estudios etológicos de pichicos barba blanca y pichicos comunes ejecutados en el GRAL han generado valiosa información, pero solamente una parte de esta información ha sido presentada en este artículo. En contraste con estudios de campo, los estudios en galpones al aire libre permiten al observador acercarse más a los animales y verlos mejor, brindado así mejores posibilidades para observar detalles del comportamiento. En comparación con animales en jaulas de laboratorio, los animales tienen acceso a más espacio, lo que les permite desarrollar en forma completa su repertorio de comportamiento. Esto no solamente aumenta las posibilidades de hacer observaciones, sino que también afecta positivamente el estado de salud de los animales. De todos los pichicos mantenidos en cautiverio en el CRCP, aquellos viviendo en el GRAL tienen el mejor estado de salud. Además, la tasa de reproducción es muy alta, con nacimientos cada año desde 1983 y un alto éxito de crianza. Eso es particularmente notable en los pichicos barba blanca, especie de difícil mantenimiento y propagación en laboratorio (Ogden 1983).
En resumen, el galpón al aire libre del CRCP es un instrumento valioso para el estudio del comportamiento y la reproducción del pichico barba blanca y pichico común. Es recomendable que se continúe los estudios etológicos y que se utilicen galpones al aire para la reproducción del pichico barba blanca.
AGRADECIMIENTOS
Estamos muy agradecidos al Proyecto Peruano de Primatología por el permiso de conducir los estudios en el galpón al aire libre del CRCP. En particular, agradecemos al Dr. Jaime Moro S. y Dr. Carlos Málaga por su apoyo. El estudio de EWH fue subvencionado por el Deutsches Primatenzentrum.
REFERENCIAS
Altmann, J. 1974. Observational study of behavior: Sampling methods. Behaviour 49:227-267.
Box, H.O. y J.M. Morris. 1980. Behavioural observations on captive pairs of wild caught tamarins (Saguinus mystax). Primates 21:53-65.
Castro, R. y P. Soini. 1977. Field studies on Saguinus mystax and other Callitrichids in Amazonian Peru. pp. 73-78. En D.G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Wash., D.C.
Cebul, M.S. y G. Epple. 1984. Father-offspring relationships in laboratory families of saddle-back tamarins (Saguinus fuscicollis). pp. 1-19. En D.M. Taub (Ed.). Primate Paternalism. Van Nostrand Reinhold, New York.
Cleveland, J. y C.T. Snowdon. 1982. The complex vocal repertoire of the adult cottontop tamarin (Saguinus oedipus). Z. Tierpsychol. 58: 231-270.
Coates, A. y T.B. Poole. 1983. The behavior of the Callitrichid monkey, Saguinus labititus in the laboratory. Int. J. Primatol. 4: 339-371.
Dawson, G.A. 1979. The use of time and space by the Panamanian tamarin, Saguinus oedipus. Folia Primatol. 31: 253-284.
Epple, G. 1968. Comparative studies on vocalization in marmoset monkeys (Hapalidae). Folia Primatol . 8: 1-40.
Epple, G. 1972. Social communication by olfactory signals in marmosets. Int. Zoo Yearb. 12: 36-42.
Epple, G. 1978. Notes on the establishment and maintenance of the pair bond in Saguinus fuscicollis. pp. 231-237. En D.G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Wash., D.C.
Epple, G., 1985. The primates 1: Order Anthropoidea. pp. 739-769. En R.E. Brown y D.V. MacDonald (Eds.). Social Odour in Mammals, Vol 2.. Oxford; Clarendon Press.
Epple, G. Y. Katz. 1980. Social influences on first reproductive success and related behaviors in the saddle-back tamarin (Saguinus fuscicollis, Callitrichidae). Int. J. Primatol. 1: 171-183.
French, J.A. y J. Cleveland. 1984. Scent-marking in the tamarin, Saguinus oedipus: sex differences and ontogeny. Anim. Behav. 32: 615-623.
Garber, P.A. 1986. The ecology of seed dispersal in two especies, of Callitrichid primates (Saguinus.mystax and Saguinus fuscicollis). Amer. J. Primatol. 10: 155-170.
Garber, P.A. (en prensa). Foraging decisions associated with nectar feeding in mixed species troops of tamarin monkeys (Saguinus mystax and Saguinus fuscicollis, Callitrichidae, Primates) in Amazonian Peru. Biotropica.
Heymann y Sicchar 9 Estudio efológico de S. mystax y S. fuscicollis 379
Garber, P.A. y M.F. Teaford. 1986. Body weight in mixed espccies troops of Saguinus mystax and Saguinus fuscicollis nigrifrons in Amazonian Peru. Am. 1. Phys. Anthrop. 71: 331-336.
Gazzo, B. (este volumen). Estudios bioecológicos de tres grupos del pichico barba blanca (Saguinus mystax Spix 1823) en Padre Isla (Iquitos).
Glander, K.E., J. Tapia y A. Fachfn. 1984. The impact of cropping on wild populations of Saguinus mystax and Saguinus fuscicollis in Peru. Amer. 1. Primatol. 7: 89-97.
Goedeking, P. 1983. Quantitative untersuchungen zur des akustischen reproductoires bei lisztaffen (Saguinus oed' oedipus). Tesis de Diploma, Universidad do Bielefeld.
Hershkovitz, P. 1977. Living New World Monkeys (Platyrrhini). Vol. 1. Univ. Chicago Press, Chicago. XIV + 1117 pp. and Figs.
Heymann, E.W. 1985. Untersuchungen zur vokalon and olfaktorischen kommunication des schnurrbarttamarins, Saguinus mystax mystax (Spix 1823) (Primates: Callitrichidae). Tesis de Doctorado, Universidad de Ciessen.
Heyman, E.W., W. Kaumanns y L. Sicchar. 1985. Urinating onto hand ("urine washing"?) in the moustached tamarin, Saguinus m. mystax (Primates; Callitrichidae). Primates Report 12: 1-6.
Kaumanns, W. 1982. Verbal tonsbcobachtungen an schnurrbart tamarinen (Saguinus m..mystax). Zeitschrift des Kolner Zoo 25: 107-117.
King, G.E. y H.D. Stoklis. 1984. New evidence for the craniocervical killing bite in primates. 1. Human Evolution 13: 469481.
McLanahan, E.B.y K.M. Green. 1977. The vocal repertoire and an analysis of the contexts of vocalizations in Leontopithecus rosalia. pp. 251-269. En D.G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Wash., D.C.
Moody, M.I. 1978. Vocal communication in the tamarin Saguinus fuscicollis. PHD Thesis, New York.
Moody, M.I. y E.W. Menzel, Jr. 1976. Vocalizations and their behavioral contents in.the tamarin Saguinus fuscicollis. Folia Primatol. 25: 73-94.
Moya, L.A., L. Verdi, P. Bocanegra y J.E. Rimachi (este volumen). An5lisis poblacional de Saguinus mystax (Spix 1823), "pichico barba blanca" en el Río Yarapa, Loreto, Perú.
Muckenhirn, N.A. (1967). The behavior and vocal repertoire of Saguinus oedipus (Hershkovitz 1966) (Callithricidae, Primates). MS Thesis, University of Maryland.
Ogden, J. 1983. Reproduction of wild-caught tamarins (Saguinus mystax mystax) under laboratory conditions. 1. Med. Primatol. 12: 343-345.
Omedes, R.A. 1983. Estudio comparado de la comunicación social del tití plateado (Callithrix argentata. Anthropos 26-27: 81-83.
Omedes, A. 1984. Vocalisations du ouistiti argenta Callithrix argentata ntelanura (Primates, Callitrichiclac) clevent plusieurs situations d'isolement. pp. 299-308. En A. de Haro y X. Espadaler (Eds.). Processus d'acquisition precoce. Les communications. Barcelona: Universitad Autónoma de Barcelona.
Pola, Y. V.y C.T. Snowdon. 1975. The vocalizations of pygniy marmosets (Cebuella pygmaea). Anim. Behav. 23: 826-842.
Ramírez, M. (1983). Recuperación poblacional de Saguinus mystax, "pichico de barba blanca" en el Río Yarapa, Loreto, Perú. Resúmenes de las Comunicaciones Científicas. IX Congreso Latinoamericano de Zoología. Arequipa, 9-15 Octubre 1983.
Ramirez, J. M. 1984a. Ecology and conservation of the moustached tamarin in Perid. ILICN Primates Specialist Group News. 4: 22-23.
Ramirez, M. 1984b. Population recovery in Saguinus mystax, the moustached tamarin, at the Yarapa River, Peru - mechanisms of recovery and management strategies. Amer. 1. Primatol. 7: 245-259.
Ramirez, M. 1985a. Exudate feeding in Upper Amazonian Saguinus and Cebuella. Am. 1. Phys. Anthrop. (Abstract) 66: 216.
Ramírez, M. 1985b. Feeding ecology of the moustached tamarin, Saguinus mystax. Am. 1. Phys. Anthrop. (Abstract) 66: 216-217.
Rasmussen, D.R. 1980. Clumping and consistency in primates patterns of range use., definitions, sampling, assessment and applications. Folia Primatol. 34: 111-139.
Snowdon, C.T. y A. Hodun. 1985. Troop-specific responses to long calls of isolated tamarins (Saguinus mystax). Amer. 1. Primatol. 8: 205-213.
Soini, P. (este volumen). Ecología y dinámica poblacional del pichico Saguinus fuscicollis, (Callitrichidae, Primates).
Soini, P. y M. Soini. (este volumen). Distribución geográfica y ecología poblacional de Saguinus mystax (Callitrichiclae, Primates).
Steklis, H.D. y G.E. King. 1978. The craniocervical killing bite: toward and ethology of primate predatory behavior. 1. Human Evolution 7: 567-581.
Sussman, R.W. y P.A. Garber. (en prensa). A new interpretation of the social organization and mating system of the Callitrichidae. Int. 1. Primatol.
Tembrock, G. 1975. Biokommunikation. Informationsubertragung im biogischen Bereich. Reinbek bei Hamburg: Rowohlt Taschenbuch Verlag.
Terborgh, J. 1983. Five New World Primates. A study in comparative ecology. Princeton; Princeton University Press.
Terborgh, J. y A. W. Goldizen. 1985. On the mating system of the cooperatively breeding saddle-backed tamarin (Saguinus fuscicollis). Behav. Ecol. Sociobiol. 16: 293-299.
Vogt, J.L. 1978a. ne social behavior of a marmoset (Saguinus fuscicollis) group. 11. Behavior patterns and social interaction. Primates 19: 287-300.
Vogt, J.L. 1978b. The social behavior of a marmoset (Saguinus fuscicollis) group. III Spatial analysis of social structure. Folia Primatol. 29: 250-267.
Vogt, J.L., H. Carlson y E. Menzel. 1978. Social behavior of a marmoset (Saguinus fuscicollis) group. I Parental care and infant development. Primates 19: 715-726.
Wilson, C.C. 1972. Spatial factors and the behavior of nonhuman primates. Folia Primatol. 18: 256-275.
Winters, M. y M. Rothe. 1979. Darstellung des lautrepertoires handaufgezogener WeiBbuschelaffchen (Callithrix jacchus) unter besonderer Berucksichtigung der flicBenden Ubergange zwischen don cinzelnen Lautgrupen. Primates 20: 259-276.
Wolters, H.J. 1978. Some aspect of role
taking behavior family groups of the cottontop tamarin, Saguinus oedipus
oedipus. pp. 259-278. En H. Rothe, H. J. Wolters y J.P. Hearn (Eds.). Biol.
Behav. Marmoset. Gottingen; Eigenverlag Rothe.

Pekka Soini
INTRODUCCIÓN
Lagothrix lagothricha es una de las especies grandes de la Amazonía y una de las más perseguidas para el consumo por los pobladores rurales de la región. La caza indiscriminada lo ha exterminado en muchos lugares dentro de su área de distribución geográfica, encontrándose en la actualidad en situación de amenazada en la Amazonía Peruana.
La Reserva Nacional Pacaya-Samiria alberga una población relativamente abundante, donde a partir de 1979 se está conduciendo un estudio sostenido de la ecología, dinámica poblacional y comportamiento de esta especie, simultáneamente a los estudios de otras especies de la fauna primatológica. Se presenta un resumen de los resultados obtenidos hasta la fecha.
DESCRIPCIÓN DEL ÁREA DE ESTUDIO
Las observaciones de campo fueron realizadas en los alrededores de la Estación Biológica de Cahuana, situada en el curso medio del Río Pacaya, en un área total aproximada de 11 km2, donde definimos como área principal de estudio y de censo poblacional a la Isla Cahuana y la zona colindante con la Cocha Cahuana (Fig. l). Excluyendo los cuerpos de agua y los pantanos abiertos ("pungales") deshabitados por monos, la extensión total del área fue 7,2 km2 , de los cuales 4 km2 corresponden a la Isla Cahuana.
El área de estudio consiste de suelos aluviales, bajos y planos, sujetos a inundación anual. El patrón climatológico anual comprende una estación lluviosa larga de Octubre a Junio y una estación relativamente seca de Junio a comienzos de Octubre (Fig. 2). El Río Pacaya empieza a elevar su caudal en Octubre, inundando todos o casi todos los terrenos del área de estudio desde Febrero a junio.
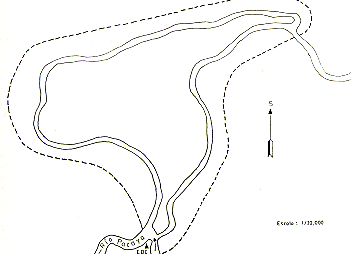
Fig. 1 .- Mapa del área de estudio,
Cahuana, Río Pacaya (escala 1:20 000).
Fenológicamente, la estación lluviosa se caracteriza por una abundancia de frutos, los que empiezan a escasear a fines de la estación, Siendo aún más notoria esta escasez en la estación seca y primeras semanas de la estación lluviosa.
MÉTODOS
Las observaciones de Lagothrix fueron realizadas periódicamente,
durante los últimos 7 años, pero con mayor intensidad a partir
de 1984 hasta la actualidad. Los monos fueron generalmente localizados en horas
de la mañana, luego seguidos por un período variable de una hora
a un día, realizando anotaciones sobre ubicación, tipo de bosque,
tamaño y composición del grupo y de las actividades y comportamiento
de sus integrantes. La ubicación y el recorrido subsiguiente del grupo
fue posteriormente ploteado en un mapa de gran escala. Durante la alimentación
de los monos, la identidad taxonómica (en lo posible) de la planta y
la parte consumida fueron anotadas. Para obtener información cuantitativa
de la dieta, cada vez que un grupo o individuo fue encontrado alimentándose
en un árbol, anotamos una observación de alimentación;
si posteriormente comieron de otro árbol, anotamos otra observación,
y así sucesivamente.
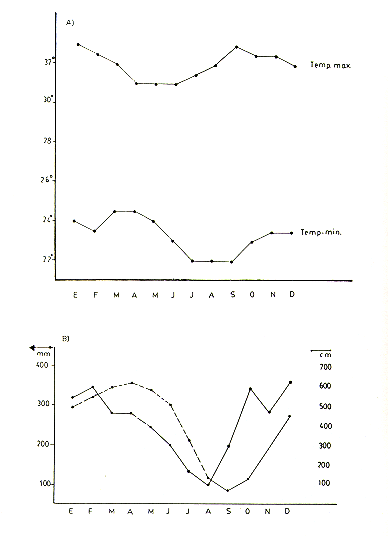
Fig. 2.-Promedios mensuales de (A) temperatura
máxima y mínima, y (B) nivel del río (linea continua)
y precipitación (linea intermitente) en el área de estudio para
el periodo 1980 - 86
.
RESULTADOS Y DISCUSIÓN
Organización social y estructura poblacional
La población de Lagothrix en el Pacaya estuvo compuesta de grupos o manadas heterosexuales. Raras veces se observaron individuos solitarios y en forma temporal, siendo éstos machos o hembras. No se observaron grupos compuestos únicamente por machos o hembras, como ocurre en los géneros Ateles y Brachyteles.
Los grupos consistieron mayormente de 3 a 10 individuos de locomoción independiente, al cual se agregaban 1 a 3 infantes cargados en la temporada anual de nacimientos. Dos o más grupos se asociaban a menudo entre sí formando coaliciones o clanes de hasta unos 20 animales. Por ejemplo, en la Isla Cahuana a mediados de 1984, tres grupos contiguos que tenían 6, 8 y 3 miembros, respectivamente (Cuadro 1) pasaban los días y noches separados, pero otras veces se juntaban para la noche, e incluso pasaron algunos días unidos o muy cerca uno del otro. Entre Octubre y Noviembre, en 12 oportunidades seguí al Grupo A, hasta la caída de la noche, en cuatro de ellas éste se juntó al atardecer con uno de los otros dos de su clan, siendo uno de ellos el Grupo B; mientras que en ocho oportunidades los grupos pasaron la noche en áreas separadas. Pasada la noche, los grupos normalmente se alejaban el uno del otro gradualmente en el transcurso de la mañana.
Cada grupo estaba compuesto de 1 a 3 machos adultos, 1 a 3 hembras adultas y un número variable de animales inmaduros. El clan de la isla, a mediados de 1984, tenía entre los adultos 5 machos y 5 hembras, 1 hembra subadulta, 2 machos juveniles mayores y 4 infantes y juveniles menores. En término medio, hubo entre los adultos igual proporción de machos y hembras, y comprendieron el 50 a 60% de la población total (Cuadros 1 y 2).
Cuadro 1.- Composición del clan de
Lagothrix lagothricha en la Isla Cahuana.
|
Adultos |
Subadultos |
juvenil 2 |
juvenil 1 |
Infantes |
Total | |||||||
| m | H | M | H | M | H | M | ? | H | M | ? | H | ||
|
2 | 1 | 1 | 1 | 1 | 6 | |||||||
|
2 |
3 |
1 | 1 | 1 |
8 |
|||||||
|
1 | 1 | 1 | 3 | |||||||||
|
5 | 5 | 1 | 2 | 1 | 1 | 1 | 1 | 17 | ||||
M = machos, H= hembras.
Cuadro 2.- Composición de otras manadas
o clanes en el área de estudio fuera de la Isla.
|
Clan |
Adultos |
Subadultos |
juvenil 2 |
juvenil 1 |
Infantes |
Total | |||||||
|
M |
H |
M |
H |
M |
H |
M |
? |
H |
M |
? |
H |
||
| 5 | 3 | 2 | 1 | 1 | 2 | 9(-10) | |||||||
| 7 | 4 | 6 | 1 | 1 | 1 | 2 | 3 | 18 | |||||
Exceptuando los nacimientos y mortalidad de crías, la composición de un grupo tiende a mantenerse estable por períodos de varios meses. Así, por ejemplo, en el transcurso de un monitoreo de 9 meses de los Grupos A y B en la isla, la composición del Grupo A se mantenía inalterada por aproximadamente 5 meses. En el Grupo B, aparte de los nacimientos y mortalidad de crías, el único cambio que hubo durante los 9 meses fue la incorporación de una hembra subadulta procedente del Grupo A hacia el final del período de monitoreo.
Estudios realizados por otros investigadores en otras áreas de bosque extenso y continuo de Selva Baja, indican que Lagothrix vive mayormente en manadas de 10-40 animales (Defier 1983, Durham 1975, Johns 1985, Fooden 1963, Izawa 1976, Nishimura e Izawa 1975, Ramírez 1980; Aquino, este volumen; Rylands 1982). Las manadas aun cuando pueden subdividirse en pequeños grupos durante horas de actividad alimentaria, éstas son marcadamente cohesivas y estables. En el Pacaya también se observaron unidades sociales de 10-20 animales, pero en contraste a las observaciones reportadas de otras áreas, éstas no fueron unidades cohesivas, sino estuvieron subdivididas en 2 ó más grupos pequeños heterosexuales, que se comportan como unidades semi-independientes durante todo el año (aunque posiblemente hay alguna fluctuación estacional).
La organización social observada en Pacaya probablemente se debe a una adaptación de la población a las condiciones ecológicas peculiares del área. El hábitat preferido de Iagothrix es el bosque alto y maduro de los terrenos elevados, y en Pacaya, este tipo de bosque está limitado a las restingas altas que, por ser antiguas orillas de río, no son formaciones extensas sino relativamente reducidas y fragmentadas, predominando los terrenos pantanosos y el bosque de bajial, con menor diversidad de especies y una producción más acentuadamente estacional de frutos. La falta de extensiones grandes e ininterrumpidas de bosque de altura (o bosque de restinga alta) probablemente no permite la subsistencia de manadas grandes y cohesivas de Lagothrix en Pacaya.
Los escasos datos disponibles sobre el tamaño de los grupos en el Río Samiria (Freese 1975, Neville et al. 1976) sugieren que también en esa parte de la Reserva los grupos también tienden a ser pequeños, debido indudablemente a una situación idéntica a la de Pacaya.
Densidad poblacional
Un censo de la población total dentro del área de estudio, realizado desde Junio hasta Agosto 1984, indicó 22 a 23 animales en la Isla Cahuana, lo que dio una densidad ecológica de 5,5 animales/km2. El mínimo número de animales observados dentro del área de estudio fue 74; pero inadvertidamente durante los conteos de los grupos, la población total fue estimada en 80 animales, por lo tanto la densidad ecológica sería de 11 individuos/km2. Sin embargo, considerando que las áreas domiciliarias de todos los grupos, se extendían considerablemente más allá de los límites del área de estudio, excepto para los de la isla, esta cifra es probablemente una sobreestimación de la verdadera densidad ecológica. Para obtener un estimado más acertado, incluimos sólo la mitad de la población periférica en el cómputo, lo que nos representó un estimado final de 7 individuos/km2 para toda el área de estudio.
Los resultados de los censos anuales en la Isla Cahuana (Cuadro 3) indican el incremento constante de la población en un período de 6 años desde el establecimiento de la Estación Biológica en 1979. Esto indudablemente es consecuencia directa de nuestra continua presencia, que evitó la caza indiscriminada de la población. En los años anteriores, la población de la isla fue la más accesible y vulnerable a la caza en comparación con las poblaciones aledañas. Estas poblaciones sirven de subsistencia a los vigilantes de la Reserva y cazadores furtivos. La densidad comparativamente baja en la isla, probablemente indica que la población todavía no alcanzó su capacidad de carga.
Cuadro 3.- Estimados anuales del tamaño
de la población de Lagothrix lagothricha en la Isla Cahuana. Censos
realizados a mediados de cada año (antes del comienzo de la temporada
anual de nacimientos).
| 1979 |
|
|
| 1980 |
|
|
|
1981 |
|
|
| 1982 |
|
|
| 1983 |
|
|
| 1984 |
|
|
| 1985 |
|
|
Preferencias de hábitat.
Lagothrix, gran parte del año muestra una marcada preferencia por el dosel continuo del bosque alto y maduro, de las restingas altas. Sin embargo, es evidente un cambio estacional en la utilización del hábitat. Desde Marzo a Junio de cada año, el bosque de bajial es más intensivamente utilizado que el bosque de restinga alta. Este cambio concuerda con el patrón general de fructificación, pues en esta época se observó abundancia de frutos.
Lagothrix permanece mayormente en los estratos medio y superior del bosque; aunque también frecuentemente se alimentan en las copas de los árboles emergentes. El estrato inferior de la vegetación es poco frecuentado y sólo en una oportunidad observé dos individuos descendiendo al suelo para recoger frutos caídos.
Uso del espacio
El área total utilizada anualmente por el clan abarcó la mayor parte de la Isla Cahuana y el área domiciliaria fue estimada en 3,5 krn2. La distancia que un grupo recorre en un día es relativamente corta, pero a veces alcanza más de 1 km. En Noviembre 1984, el recorrido diario del Grupo A fue monitoreado por 7 días. La distancia diaria durante este período varió de 100 a 550 m, con un promedio de 390 m. Una muestra más amplia del recorrido diario abarcando varios meses del año, dio una distancia promedio de 553 m y un rango de 100-950 m (N = 15). Durante las actividades alimenticias, los miembros de un grupo estaban a menudo muy dispersos, abarcando un área circunscrita de 1 ha o más.
Selección de lugares de dormir
Los grupos siempre pasan las noches en el estrato superior del bosque. Los integrantes de un grupo durmieron a menudo dispersos en tres o cuatro árboles ubicados muchas veces entre 50 a 100 m entre uno y otro árbol; nunca recorrieron distancias mayores con el propósito de pernoctar en un árbol dado; más bien al caer la noche con frecuencia quedaron a dormir, particularmente machos adultos y subadultos, en la copa del mismo árbol en que se encontraban comiendo, actividad que continuaban al amanecer. Dormían solos o en pequeñas agrupaciones que con frecuencia estaban formadas por una hembra adulta y uno o dos juveniles de su prole. Al parecer preferían dormir sobre las partes distal y media de las ramas mayores que en la parte cercana al tronco.
Las actividades de un grupo cesaban normalmente entre las 18:00-18:15 h, es decir, después de la puesta del sol. En la mañana, las actividades eran reiniciadas entre las 05:15 h y 05:45 h. El período total de actividad diaria varió generalmente entre 12,5 y 13 h.
Dieta
La dieta de Lagothrix en el área de estudio consistió principalmente de frutos, semillas, flores, hojas y brotes terminales de lianas; ocasionalmente también comieron peciolos y partes terminales de raíces aéreas de epífitas. La población en estudio fue observada alimentándose de los frutos de aproximadamente 69 especies entre árboles, lianas y hemiepífitas; de las semillas de 12 especies de árboles; de las hojas y brotes terminales de 13 especies de árboles, lianas y epífitas, y de las flores de 7 especies entre árboles, lianas y epífitas. El Cuadro 4 contiene una lista de las plantas alimentarias.
Cuadro 4.- Recursos a :os de Lagothrix Lagothricha en Cahuana, Río Pacaya.
|
Tipo de planta |
Temporada de consumo |
|
|
Recurso de frutos |
|||
|
Spondias mombin |
A |
Nov.-Feb. |
|
Crematosperma sp. |
A |
jun. |
|
Xylopia ligustrifolia |
A |
Feb. |
|
|
Quararibea sp. (?) |
A |
jul. |
|
Cordia nodosa |
A |
Oct. |
|
Cordia ulei |
A |
Oct.-Nov. |
|
|
Maripa axiliflora |
L |
JuL-Ago. |
|
Drypetes peruviana |
A |
Nov. |
|
Casearia arguta |
A |
jun. |
|
Tovomita sp. |
A |
Feb. |
|
Rheedia acuminata |
A |
Set. |
|
|
Ocotea Sp. (7) |
A |
Abr. |
|
Andira inermis |
A |
Oct. |
| Inga ingoides |
A |
Dic.-Feb.,Ago. | |
| Inga aff. punctata |
A |
Ene.-Mar. | |
| Inga sp. # 1 |
A |
Mar. | |
| Inga sp. # 2 |
A |
Feb. | |
|
Abuta fluminum |
L |
Ago,-Oct. |
| Odontocarya tripetala |
L |
Ago.-Set. | |
| Orthomene aff. schomburgkii |
L |
May. | |
| (# P.231) |
A |
May. | |
|
Brosimum rubescens |
A |
Mar.-Ago., Nov.-Dic. |
| Cecropia membranacea |
A |
Feb. | |
| Clarisia biflora |
A |
Jun.-Jul., Nov.-Mar. | |
| Coussapoa schunkei |
A/H |
Oct.-Feb. | |
| Coussapoa trinervia |
A/H |
Jun. | |
| Coussapoa villosa |
A/11 |
Feb. | |
| Ficus gemina |
A/14 |
Feb., jun.,Set.-Oct. | |
| Ficus maxima |
A/H |
Nov.-Feb. | |
| Ficus obtusifolia |
A |
Nov. | |
| Ficus sp. #1 |
A |
Abr., Ago.-Ene. | |
| Ficus sp. #2 |
A/H |
Jun., Set. | |
| Ficus sp. #3 |
H |
Oct. | |
| Ficus sp. #4 |
H |
Nov. | |
| Ficus sp. #5 |
H |
Set.-Nov. | |
| Ficus Sp. #6 |
H |
Jul. | |
|
Ficus sp. #7 |
H |
Oct.-Dic. |
|
| Ficus sp. #8 |
A |
May. | |
| Perebea sp. |
A |
Nov. | |
| Pourouma cecropiaefolia |
A |
Feb. | |
| Sorocea hirtella |
A |
Nov. | |
|
Calyptranthes crebra |
A |
Dic. |
| Eugenia egensis |
A |
Ene.-Abr. | |
| Psidium acutangulum |
A |
Ene.-Feb. | |
|
Cathedra cf. acuminata |
A |
Feb., Jun. |
|
Iriartea exhorriza |
A |
Feb.-Abr., Oct.-Nov. |
|
Coccoloba ovata |
A |
May. |
|
Coccoloba sp. |
A |
Nov. |
|
|
Couepia sp. |
A |
Feb. |
|
Genipa americana |
A |
Set. |
|
Paullinia obovata |
L |
Jun. |
| Paullinia paullinoides |
L |
Feb. | |
| Allophyllus sp. (?) |
A |
Nov.-Dic. | |
|
Pouteria sp. #1 |
A |
Feb. |
| Pouteria sp. #2 |
A |
Feb. | |
| Pouteria sp. #3 |
A |
Feb. | |
| Pouteria sp. #4 |
A |
Mar.-May. | |
|
Leonia glycycarpa1 |
A |
Mar.,Set. |
|
Recurso de semillas (pepas)
|
|||
|
Tapura coriacea |
A |
Ene. |
|
Eschweilera timbuchensis2 |
A |
Oct-Mar. |
|
Gustavia iquitesensis2 |
A |
Oct.-Nov. |
|
|
Acacia loretensis |
A |
Ago. |
|
Inga aff. punctata |
A |
Nov., Feb. |
|
|
Virola surinamensis |
A |
Oct-Dic. |
|
Licania aff. apetala |
A |
Ene. |
|
Parinari excelsa |
A |
May. |
|
|
Pouteria sp. #5 |
A |
Ene. |
|
(# P.262) |
A |
Nov.-Dic. |
|
|
Recurso de hojas y brotes |
||
|
Heteropsis sp. |
E |
Nov. |
|
Monstera sp. |
E |
Oct. |
|
|
Gen. sp. |
E |
Set. |
|
Ocotea sp. (?) |
A |
May. |
|
Acacia loretensis |
A |
Nov.-Dic. |
|
Odontocarya tripetala |
L |
Set. |
|
Guazuma ulmifolia Recurso de flores
|
A |
jul. |
|
Bacageopsis multiflora |
A |
Set. |
|
Arrabidaea sp. |
L |
Nov. |
| Paragonia pyramidata |
L |
Oct.-Nov. | |
|
Ceiba samauma |
A |
Oct.-Nov. |
|
Inga punctata |
A |
Ene. |
1 Posiblemente incluye consumo de semillas
2 Posiblemente incluye consumo de mesocarpio.
A = árbol; E= epífita; H= hemiepífita o estrangulador; L= liana.
Aparte de los recursos vegetales, Lagothrix fue observado en algunas oportunidades capturando o ingiriendo pequeños insectos o arácnidos. Otras veces, examinaban cuidadosamente el interior de hojas enrolladas y lamían algo, posiblemente crisálidas, o escudriñaban detenidamente en la base interior de las bromelias. Es evidente que su dieta también incluye invertebrados en pequeñas cantidades. En otras regiones de la Amazonía también han constatado, mediante examen del contenido estomacal, pequeñas cantidades de artrópodos (Izawa 1975, Milton y Nessimian 1984).
La relativa importancia cuantitativa de los diferentes
productos vegetales en la dieta anual de la población, en términos
de frecuencia con que los Lagothrix fueron encontrados alimentándose
en 269 observaciones de alimentación, es aproximadamente la siguiente:
|
77% |
|
14% |
|
7% |
|
2% |
Los frutos constituyen el recurso alimentario más importante durante todo el año. Además de frutos maduros también consumían frutos inmaduros de varias especies, particularmente de Coussapoa spp. e Inga aff. punctata. Los frutos embrionarios de esta última especie fueron íntegramente consumidos, mientras que de los frutos maduros solamente el arilo. En la mayoría de las especies la parte consumida era el mesocarpio o arilo; las semillas eran desechadas o tragadas intactas.
Lagothrix se alimenta mayormente en los árboles grandes, de copas amplias y a menudo emergentes. Aproximadamente el 64% del consumo de frutos o semillas correspondía a los árboles grandes y a los estranguladores o hemiepífitas que crecían en sus copas; 21% correspondía a los árboles medianos del estrato medio del bosque y de copas relativamente reducidas; el 77% representado por árboles pequeños del estrato inferior y el restante 8% a las lianas.
El género Ficus, con aproximadamente 13 especies, es la fuente más importante de frutos; fueron consumidos durante todo el año y comprendieron el 17% de las observaciones del consumo de frutos o 13% de todas las observaciones de alimentación. El género Coussapoa, con tres o más especies, fue el segundo en importancia; sus frutos fueron consumidos desde Octubre a Febrero y luego en Junio, representando el 12% del consumo de frutos o 9% de toda la alimentación observada. El siguiente en importancia fue Brosimum, con una o dos especies, cuyos frutos fueron consumidos desde Marzo hasta Agosto y Noviembre a Diciembre, respondiendo por el 8% del consumo de frutos. Los frutos de toda la familia Moraceae, incluyendo los tres géneros mencionados, fueron el componente más importante de la dieta de.Lagothrix en Pacaya significando el 44% del consumo total de frutos o 34% de toda la alimentación observada. El género Inga, con cinco especies consumidas fue otro de los más importantes, entre Noviembre y Marzo, constituyendo el 11 % del consumo total observado de frutos.
De las aproximadamente ocho especies de palmeras en el área de estudio, únicamente los frutos de Iriartea exorrhiza fueron consumidos por Lagothrix. En los siete casos observados, los machos adultos fueron los únicos consumidores. Cabe anotar que Mauritia flexuosa, palmera muy común en la región y de cuyos frutos se alimentaba Lagothrix en otras partes (Hernández Camacho y Cooper 1976; obs.pers.), no se encuentra en el área de estudio, pero es abundante en otras partes de la Reserva.,
De las especies, cuyas semillas se alimenta Lagothrix, Eschweitera timbuchensis fue la fuente más importante. El consumo se extendía desde Octubre a Marzo y comprendía el 39% del consumo total de semillas o 7% de toda la alimentación observada. Otras fuentes relativamente importantes fueron Inga aff. punctata, Virola surinamensis y una especie no identificada de Menispermaceae, de quienes, Lagothrix probablemente consumía semillas de los frutos maduros.
La alimentación también incluía hojas maduras, hojas nuevas, cogollos y brotes terminales de lianas. La masticación de la parte basal o meristemo de la hoja de bromelias, posiblemente se debió al contenido de agua, puesto que se observó en plena estación seca. Del consumo de hojas y brotes terminales, aproximadamente 50% correspondió a lianas, 37% a árboles y 13% a epífitas.
Fluctuación temporal de la composición de la dieta. Los frutos constituyeron cuantitativamente el recurso más importante durante todos los meses del año. En la estación seca, los frutos comprendieron el 69% del consumo de vegetales y el 79% en el resto del año.
El consumo de semillas fue observado en todos los meses del año, excepto en Abril y Junio. Sin embargo, la mayor contribución a la dieta fue de Octubre a Enero, constituyendo el 24% de todas las observaciones de alimentación para esta temporada. De Febrero a Setiembre, la contribución fue de 5% en la alimentación.
El consumo de hojas y brotes fue observado en casi todos los meses del año, pero la contribución significativa ocurrió de Setiembre a Octubre, con el 20% de la alimentación observada. Durante el resto del año su consumo comprendió, en término medio, el 4% de las observaciones mensuales.
Las flores constituyen un recurso relativamente insignificante, siendo con sumidas mayormente de Setiembre a Noviembre, por lo que su contribución en este período fue de 5% de la alimentación y 1% durante el resto del año.
En conclusión, el consumo de hojas, brotes y flores es más intenso desde la segunda mitad de la estación seca hasta principios de la estación lluviosa, coincidente con la mínima disponibilidad de frutos. Por otro lado, el período de consumo intensivo de semillas coincide con el período de mayor disponibilidad de semillas relativamente grandes e inmaduras; el mínimo consumo ocurre a fines de la estación lluviosa y durante casi toda la estación seca coincidentes con la ausencia o escasez de semillas adecuadas para el consumo.
Relaciones con otras especies
En el área de estudio, Lagothrix comparte el hábitat y sus recursos con otras seis especies de monos, con las cuales se le observó alimentándose en asociaciones circunstanciales o pasivas en árboles frutales de gran tamaño. No obstante, Lagothrix no fue observado en activa asociación con ninguna otra especie. Entre Lagothrix y Alouatta seniculus se observó que existe una relación competitiva y moderadamente agonística en el área de estudio, donde Lagothrix resultó dominante, principalmente en situaciones de alimentación.
Reproducción
De un total de 23 neonatos nacidos en el transcurso del estudio, excepto dos, los demás nacieron entre Setiembre y Abril (60% de ellos entre Setiembre y Noviembre); los dos restantes nacieron en Julio y fines de Agosto, respectivamente. Por lo tanto, Lagothrix presenta un período de nacimientos anual y definido que comienza a fines de la estación seca y culmina a mediados de la temporada lluviosa; fuera de esta temporada, son pocos los nacimientos. Observaciones de crías adicionales mayores, cuyos períodos de nacimiento sólo fueron estimados, corroborando lo antedicho. Cópulas en la población de estudio se observaron en los meses de Enero, Febrero y Setiembre.
Cuidado y desarrollo de las crías
Los neonatos presentan un pelaje claro, de color paja, que contrasta con el color pardo oscuro de los animales mayores. Durante las primeras 4-8 semanas, los neonatos son cargados sobre el vientre y el pecho, luego en la espalda. Entre estas dos fases generalmente hay un período de transición de 1 a 2 semanas, donde el infante durante el transporte se sujeta al flanco de su madre.
Los infantes son cargados hasta 5 ó 6 meses de edad, aunque a partir de los 2 a 3 meses, fueron observados movilizándose a través de sus propios miembros durante las horas de descanso y alimentación. Después del sexto mes, el traslado es ocasional principalmente en situaciones de peligro o angustia y en pasajes arbóreos difíciles, como el distanciamiento entre dos árboles, donde las madres hacen de puente con su cuerpo y extremidades, superando así el obstáculo para sus infantes. Al segundo año de vida, los infantes todavía siguen a sus madres en los talones, particularmente durante recorridos y busca de alimento. Los infantes fueron observados comiendo frutos a los tres meses de edad; no obstante, por lo menos algunos infantes observados todavía lactaban ocasionalmente en su segundo año de vida.
AGRADECIMIENTOS
El presente estudio fue realizado dentro del programa de estudio y evaluación de fauna de la Reserva Nacional Pacaya-Samiria, ejecutado por la Región Agraria XXII-Loreto, del Ministerio de Agricultura. El programa iniciado en 1979 recibió, en los primeros años, apoyo financiero del Gobierno Suizo a través de la Cooperación Técnica Suiza. En el período Febrero 1984~ Enero 1985, el estudio de primates en la cuenca del Río Pacaya recibió apoyo financiero del ^F-U.S. Las muestras de plantas alimentarias de L. lagothricha fueron identificadas por el Dr. Sydney McDaniels (Institute for Botanical Exploration, Mississippi State, MS) y Dr. Franklin Ayala (Universidad Nacional de la Amazonía Peruana, Iquitos), a quienes se agradece por su valiosa colaboración. Mi esposa, María Coppula de Soini compartió conmigo la vida de campo durante todo el período de estudio y contribuyó de muchas maneras a la realización del estudio. Estoy profundamente agradecido a Russ Mittermeier por el continuo estímulo y apoyo que me ha brindado en el transcurso de los años de estudio de campo.
REFERENCIAS
Aquino, R. (este volumen). la fauna primatológica en áreas de Jenaro Herrera (Requena, Loreto).
Defler, T.R. 1983. Observaciones sobre los primates del Bajo Río Mirití-Paraná, Amazonas, Colombia. Lozania 46:1-13.
Durham, N.M. 1975. Some ecological, distributional, and group behavior features of Atelinae in Southern Peru: With comments on interspecific relations. pp. 87-101. En R.H. Tutle (Ed.) Socioecol. Psychol. Primates. Mouton Publisher.
Fooden J. 1963. A revision of the woolly monkeys (genus Lagothrix). J. Mammal. 44: 2i 3-247.
Freese, C. 1975. Final Report: A census of nonhuman primates in Peru: Health Organization, Washington, D.C. 49 pp.
Hernández-Camacho J. y R.W. Cooper. 1976. The nonhuman primates of Colombia. pp. 35-69. En R.W. Thorington y P.C. Heltne (Eds.). Neotropical Primates, Field Studies and Conservation. National Academy of Sciences, Washington, D.C.
Izawa, K. 1975. Foods and feeding behavior of monkeys in the Upper Amazon basin. Primates 16: 295-316.
lzawa, K. 1976. Group sizes and compositions of monkeys in the Upper Amazon basin. Primates 17: 367-399.
Johns, A. 1985. Primates and forest exploitation at the Brazilian Amazonia. Primate Conserv. 6: 27-29.
Milton, K. y J.L. Nessimian. 1984. Evidence for insectivory in two primates species (Callicebus torquatus lugens and Lagothrix lagothricha lagothricha) from northwestern Amazonia. Amer. 1. Primatol. 6: 367-371.
Neville, M., N. Castro, A. Mármol y J. Revilla. 1976. Censusing primate populations in the reserved area of the Pacaya and Samiria rivers, Dept. Loreto, Perú. Primates 17: 151-181.
Nishimura, A. y K. Izawa. 1975. The group characteristics of woolly monkeys (Lagothrix tagothricha) in the Upper Amazonian Basin. pp. 351-357. En S. Kendo, M. Kawai y A. Ehara (Eds.). Contemporary Primatol. Karger, Basel.
Ramirez, M. 1980. Grouping patterns of the woolly monkey, Lagothrix lagothricha, at the Manu National Park, Peru. Am. 1. Phys. Anthrop. (Abstract.) 52: 269
Rylands, A.B. 1982. The behavior and ecology of three
species of marmosets and tamarins (Callitrichidae, Primates). Tesis Doctoral,
Univ. of Cambridge.

