

NOTA SOBRE EL HALLAZGO DE UNA SUBESPECIE ADICIONAL DE Saguinus fuscicollis (CALLITRICHIDAE, PRIMATES) PARA EL PERU
(Informe presentado a Ministerio de Agricultura en Diciembre 1978).
Pekka Soini
De Saguinus fuscicollis Spix, especie politípica y de amplia distribución en la Amazonía ' se ha señalado para el país la existencia de seis razas geográficas o subespecies (Hershkovitz 1968 y 1977); éstas son: S. f. illigeri, S. f. lagonotus, S. f. leucogenys, S. f. nigrifrons, S. f. tripartitus y S. f. weddelli.
En el transcurso de estudios primatológicos efectuados en la cuenca del Río Tapiche (Dpto. de Loreto, Provincia de Requena) durante el período de junio a Noviembre 1978, tuve la oportunidad de constatar la existencia de tres subespecies distintas de Saguinus fuscicollis . S. f. fuscicollis Spix, es la nueva subespecie y fue anteriormente conocida solamente en las cuencas de Yurúa y Yavarí en Brasil (Hershkovitz 1977).
La nueva subespecie fue encontrada habitando los bosques de la margen derecha del Tapiche, desde el Caserío San Pedro, en dirección Sur hasta aproximadamente el Caserío Santa Elena (Fig. l).
Aun cuando no fue posible confirmar su distribución geográfica en el Perú, por el Norte probablemente se extiende hasta la margen izquierda del Río Blanco, afluente derecho del Tapiche. Los límites meridionales no pudieron ser determinados en este estudio. La margen derecha del Bajo Tapiche, desde la desembocadura hasta la confluencia con el Río Blanco, es habitada por S. f. nigrifrons; mientras que toda la margen izquierda del Bajo y Medio Tapiche es habitada por S. f. illigeri. La distribución geográfica de esta última se extiende en la margen izquierda del Río Ucayali.
Las subespecies de S. fuscicollis fueron descritas detalladamente por Hershkovitz (1977). S. f. fuscicollis se distingue conspicuamente de las otras por el color peculiar de su cabeza, donde el pelaje de la frente muestra fuerte contraste con el color negruzco de las zonas cefálicas circundantes.
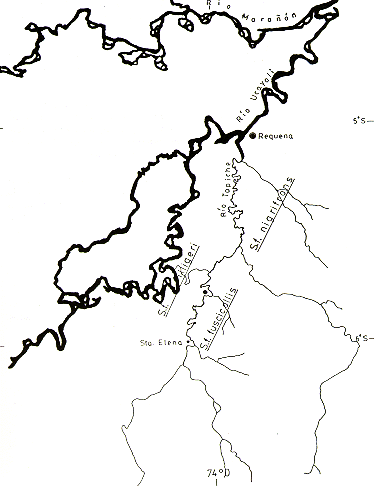
Fig. 1. - La distribución observada de S. f. nigrifons S. f. fuscicollis en la cuenca del río Tapiche.
Durante los estudios en la cuenca del Tapiche se atraparon para el Centro de Reproducción y Conservación de Primates No Humanos de Iquitos varios ejemplares de S. fuscicollis, que incluyeron 34 ejemplares de la nueva subespecie. Las medidas principales de los adultos y hembras de esta subespecie se presentan en el Cuadro 1. Medidas comparativas de las muestras poblacionales adultas (Cuadro 2) muestran algunas diferencias en el tamaño entre estas subespecies, donde S. f. illigeri fue significativamente más pequeño que S. f. fuscicollis y S. f. nigrifrons.
Además de las diferencias físicas, las vocalizaciones de larga distancia (y posiblemente otras) muestran diferencias subespecíficas, claramente discernibles al oído humano (observaciones personales) y también cuantitativamente demostrables (Hodun et al. 1981), que permiten en el campo el reconocimiento de una subespecie con sólo escuchar su vocalización.
En ciertos aspectos de comportamiento, también se observan diferencias aparentemente consistentes entre subespecies. Por ejemplo, el empleo de la protrusión exagerada y ritualizada de la lengua como señal de comunicación visual (Zungeln de Epple 1967) es arcadamente más frecuente en S. illigeri que en S. f. fuscicollis y S. f. nigrifrons (observaciones personales).
AGRADECIMIENTOS
A mi esposa María Coppula de Soini, quien me acompañó todo el período de estudio y participó intensivamente en el examen de los monos atrapados y observaciones de campo.
Cuadro 1.- Algunas medidas de los ejemplares
adultos (con desarrollo dentario completo) de S. f. fuscicollis atrapados
en San Pedro, Río Tapiche. Los individuos fueron pesados y medidos en
la fecha de su atrape o al día siguiente. Las medidas longitudinales
fueron tomadas con exactitud de 1 mm.
|
|
Machos | H e m b r a s | ||||
|
X |
rango |
n |
X |
rango |
n |
|
|
328 |
290-355 |
(9) |
338 |
300-400 |
(10) |
|
523 |
497-541 |
(10) |
524 |
483-553 |
(13) |
|
207 |
204-212 |
(10) |
208 |
191-216 |
(13) |
|
317 |
292-335 |
(10) |
316 |
269-338 |
(13) |
|
64 |
(1) |
66 |
62-67 |
(5) |
|
|
28 |
(1) |
27 |
25-28 |
(5) |
|
Cuadro 2.- Comparación
de algunas medidas de S. f. fuscicollis con las otras subespecies presentes
en la cuenca del Río Tapiche. Las medidas de ambos sexos están
combinadas en las muestras. Aquellas medidas de S. f. illigeri y de S.
f. nigrifrons que resultaron significativamente diferentes de las medidas
de S. f. fuscicollis en la prueba estadística de "Student"
(test - t) para dos colas están señaladas con 1 a 3 asteriscos,
según el nivel de significación de la diferencia: * = P < 0,05;"
= P < 0,01;*** = P < 0,001.
|
|
S. f. illigeri |
S. f. fuscicollis |
S. f. nigrifrons |
||||||
| X D.E. | (n) | X | E.E. |
(n) |
X _ | E.E. | (n) | ||
|
293,5 | 28,39 *** | (13) | 333,2 | 27,65 | (19) | 366,3*** | 35,09 | -39 |
|
509,7 |
15,84 * |
(14) |
523,4 |
16,69 |
(23) |
528,7 |
21,27 |
(50 |
|
202,8 |
7,41 * |
(14) |
207,4 |
4,56 |
(23) |
207,9 |
8,13 |
M) |
|
307,4 |
11,30 |
(14) |
316,0 |
16,20 |
(23) |
320,8 |
16,47 |
-50 |
X = promedio; D.E. = desviación estándar;
n = número de animales.
REFERENCIAS
Epple, G. 1967. Vergleichende untersuchungen über sexual-und sozialverhaltert der Krallenaffen (Hapalidae). Folia Primatol. 7: 37-65.
Hershkovitz, P. 1968. Metachromism or the principle of evolutionary change in mammalian tegumentary colors. Evolution 22: 556-575.
Hershkovitz, P. 1977. Living New World Monkeys (Platyrrhini). Vol. 1. Univ. Chicago Press, Chicago. xiv + 1117 pp. and Figs.
Hodun, A., C.T. Snowdon y P. Soini. 1981. Subspecific
variation in the long calls of the tamarin, Saguinus fuscicollis. Z. Tierpsychol.
57: 97-110.
RECONOCIMIENTO PRELIMINAR DE POBLACIONES DE Cacajao calvus "huapo rojo" (CEBIDAE, PRIMATES) EN EL ORIENTE PERUANO
Rolando Aquino
INTRODUCCIÓN
Entre los primates del neotrópico, Cacajao calvus es una de las especies menos estudiadas en su medio natural. La escasa información existente motivó al autor llevar a efecto censos por transecto, a fin de estimar las densidades poblacionales. Los resultados preliminares se presentan en este artículo.
ÁREAS DE ESTUDIO
Las áreas de estudio están ubicadas en la llanura amazónica, aproximadamente entre 4°00' a 6°20' S y 72°00' a 73°30' O. Comprendieron los bosques de Jenaro Herrera, en la cuenca del Río Ucayali, bosques de los Ríos Orosa y Blanco en la cuenca del Río Amazonas y bosques del Río Alto Tapiche en la cuenca del Río Tapiche (Fig. l). En las áreas citadas, notamos el mismo tipo de suelo, pero sujetos a variables efectos periódico-estacionaIes de los flujos de masas de agua blanca, negra o de mezcla, y diferentes formaciones vegetales.
En Jenaro Herrera, Orosa y Blanco, el suelo es arcilloso y de relieve ondulado. Gran parte de los bosques es de Colina o Altura, representados por una vegetación vigorosa, con árboles de fustes delgados, pero que sobrepasan los 30 m de alto, algunos árboles emergentes alcanzan 40 m o más. Exceptuando a los bosques del Río Blanco, los demás presentaron un aspecto moderadamente disturbado producto de la extracción de árboles de alto valor comercial. La caza de los primates fue evidente e incluyó Cacajao calvus. En contraste, el Río Blanco presentó un aspecto mucho más disturbado, tanto por la extracción de árboles de valor comercial como por la influencia de la agricultura y ganadería; apreciándose la más alta presión de caza que incluyó primates de tamaño pequeño.
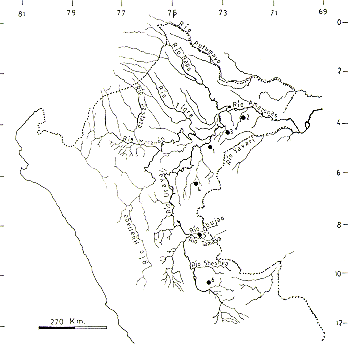
Figura 1.- Mapa del Perú mostrando
los lugares censados
1. Jenaro Herrera, 2. R. Orosa, 3. R. Blanco, 4. Alto Tapiche.
En el Alto Tapiche, el suelo es igualmente arcilloso, de relieve ligeramente ondulado e inundado por masas de agua blanca y negra en una sola época de creciente. El bosque en su mayoría de tipo bajial, está representado por Mauritia flexuosa, Scheelea cephalotes, Scheclea bossleriana y Ficus spp. en verdaderas asociaciones denominadas aguajales, shapajales, shebonales y renacales. En general, el bosque presentó un aspecto moderadamente disturbado producto de la extracción selectiva de especies forestales como Chorisia insignis y Clarisia biflora. La caza en comparación a las demás áreas de estudio fue relativamente inferior y afectó únicamente Cébidos grandes y ocasionalmente a los de tamaño mediano.
MATERIAL Y MÉTODOS
En este estudio, los censos fueron conducidos esporádicamente desde 1978 a 1986. El método usado fue el de transecto, descrito por Southwick y Cardigan (1972), con la modificación de Freese et al. (1982). Para el censo, un grupo integrado por tres observadores hicimos uso de las trochas aperturadas por los campesinos hacia el interior del bosque con fines de caza y recolección forestal. Los censos fueron ejecutados a pie, equipados de una grabadora portátil, binocular y contómetro manual. El área censada fue calculada multiplicando la distancia recorrida por el campo auditivo/visual estimado en 190 m (promedio aritmético de 4 encuentros). La densidad de manadas por km2 fue calculada utilizando la fórmula de King.
Los censos en la mayoría de los casos fueron conducidos desde las 07:00 a 13:00 horas. Los primates fueron descubiertos por audición de las vocalizaciones y/o ruidos ocasionados durante la locomoción.
RESULTADOS Y DISCUSIÓN
Hábitat
Cacajao calvus fue encontrado habitando preferentemente los bosques de altura y restingas altas de los bosques de bajial, lo cual contrasta con las sostenidas por Mittermeier y Coimbra-Filho (1977) y Fontaine (1979, 1981). Para sus actividades de locomoción, alimentación y posiblemente descanso y sueño, ocupan el estrato superior y los árboles emergentes. En época de fructificación incursionan a los aguajales y renacales en procura de alimentos. Es muy probable que en estas vegetaciones permanecen por tiempo más o menos prolongado hasta el agotamiento de los frutos.
Hasta ahora todos los encuentros ocurrieron en el interior del bosque, a más de 2 km de la ribera de los ríos, lo que hace suponer que esta especie por razones de supervivencia evita frecuentar la vegetación de ribera. Este carácter poco usual, explicaría la aparente ausencia durante los censos en años anteriores en el lado meridional del Amazonas.
Densidad poblacional
Un total de cuatro manadas fueron localizadas en una trayectoria de 193,5 km; aparte otra manada fue localizada fuera de censo. Exceptuando al Río Blanco, las densidades estimadas, para las áreas estudiadas variaron desde 0,07 a 0,23 man./km2, con un promedio de 0,08 man./km2 (Cuadro 1). El Río Blanco fue el único lugar donde en una trayectoria de 81 km no logramos ubicar a estos primates. Sin embargo, el hallazgo en 1984 y 1985 de dos manadas próximas a la Estación Biológica por Rodríguez (com. pers.) y luego por Castro (com. pers.), y la existencia en el Centro de Reproducción y Conservación de Primates No Humanos en Iquitos de dos juveniles procedentes de este río, evidencian la presencia de esta especie aunque posiblemente en densidades mucho más bajas a las registradas para las otras áreas.
Tamaño de manada y composición
De las manadas contactadas, solamente en una logramos el conteo total, que estuvo integrado por 42 individuos entre adultos y juveniles, y siete infantes sin locomoción propia. En los demás, los conteos fueron incompletos y oscilaron entre 17 a 73 individuos (Cuadro 2). La manada de mayor tamaño fue observada en el Orosa integrada por aproximadamente 100 a 120 individuos, coincidentes con la información de Mittermeier y Coimbra-Filho (1977) en Brasil. En efecto, la manada por su gran tamaño fue advertida aproximadamente a 150 m de distancia y confundida inicialmente con una manada de Tayassu pecari, pero al aproximarnos logramos identificar la vocalización tan peculiar e inconfundible de esta especie. Aun cuando los contactos en algunos casos tuvieron más de 30 minutos de duración, por el considerable tamaño, desafortunadamente en ninguna de ellas fue posible determinar a sus componentes. No obstante, en cada una notamos la presencia de varios adultos de ambos sexos, entre éstos habían hembras que transportaban a sus infantes; mientras que entre los machos, algunos parecían dominantes sobre el resto de la población y eran éstos quienes lideraban a los demás durante la locomoción.
Cuadro 1.- Densidades estimadas para Cacajao
calvus en las áreas estudiadas: censo por transecto.
|
Tipo de bosque | Distancia censada (km) | Manada/km' |
|
Altura | 77,0 | 0,07 |
|
Altura | 12,5 | 0,4 |
|
Altura | 81,0 | 0,0 |
|
Balial | 23,0 | 0,23 |
|
193,5 | 0,08 |
Cuadro 2.- Tamaños estimados de las
manadas de Cacajao calvus.
|
Fecha de observación |
Tamaño |
|
| Contadas |
Estimadas |
||
|
Jun-78 | 20 | 35 - 40 |
|
May-82 | 73 | 100 - 120 |
|
Mar-86 | 42* | - - |
|
Mar-86 | 17 | 30-35 |
* Corresponde a la única manada con conteo total.
Asociaciones Interespecíficas
Tres de las manadas estuvieron asociadas con otros Cébidos. La primera fue observada en el Orosa, movilizándose conjuntamente con dos ejemplares de Pithecia monachus, que permanecían en típica posición de liderazgo hasta antes de ser descubiertos, luego éstos huyeron en dirección distinta a la de Cacajao. Las otras manadas mixtas fueron observadas en el Alto Tapiche; primero con Lagothrix lagothricha y luego con Cebus apella conjuntamente con Saimiri boliviensis. En el primer caso, al instante de descubrirlos, ambos estaban alimentándose de frutos de Mauritia flexuosa, además notamos que algunos ejemplares de Cacajao arrancaban los frutos verdes del racimo y los arrojaban al piso después de mordisquearlos. La asociación continuó aun durante la huida. La segunda manada mixta fue localizada movilizándose bajo el liderazgo de Cebus apella en una restinga alta próxima a la orilla de un aguajal. Esta asociación terminó después de habernos descubierto, internándose Cacajao al aguajal, en tanto que sus acompañantes continuaron por la restinga.
Las asociaciones observadas con Cebus apella y Saimiri boliviensis coinciden con las informaciones de Abordo et al. (1975) y Mittermeier y Coimbra-Filho (1977) en bosque seminatural de Florida y en Brasil, respectivamente. Con Lagothrix lagothricha y Pithecia monachus se registran por primera vez. Estas asociaciones parecen frecuentes; sin embargo, la finalidad no está muy clara, más aún si consideramos la gran competencia alimenticia que existe entre estos primates.
Presión de caza y situación actual
No existen datos cuantitativos sobre la caza de Cacajao; sin embargo, esta actividad continúa y con mayor intensidad. Si la caza fuera únicamente con fines de subsistencia, el problema que hoy visualizamos no tendría mayor relevancia para la supervivencia de la especie. Lamentablemente, la caza en la actualidad tiene un fin lucrativo. Aquí es preciso destacar a los cazadores por excelencia y a los extractores de madera, como los auténticos predadores en potencia, quienes incentivados economicamente por los expendedores de "carne de monte", se dedican al abastecirrúcrito constante de dicho producto. Para citar un ejemplo, en Marzo de 1986, un cazador en el Alto Tapiche transportaba cinco ejemplares adultos muertos, todos según sus propias versiones pertenecían a la misma manada. El destino de los restos y despojos de estos primates, según continuó manifestando, era el mercado de Iquitos. Existe seguridad que acontecimientos similares ocurren cotidianamente en otras cuencas de nuestra amazonía.
Las consecuencias de la caza indiscriminada ya se hacen evidentes en algunas áreas. El Río Blanco es un buen ejemplo, donde a pesar de los esfuerzos realizados no logramos ubicar a la especie. Este resultado es un índice del exterminio paulatino de las reducidas poblaciones aún existentes, de modo que urge la protección de un área para la preservación de la especie considerada en situación amenazada.
RESUMEN
Censos por transecto fueron conducidos en bosques de altura y de bajial en el Oriente Peruano. Los resultados indican una densidad entre 0,07 a 0,23 man./km2 y un promedio de 0,08 man./km2
El hábitat de estos primates son los bosques de altura y las restingas altas de los bosques de bajial. Durante la época de fructificación frecuentan las asociaciones de Mauritia flexuosa y de Ficus spp. conocidas como "aguajales" y "renacales", de cuyos frutos gustan alimentarse.
Las manadas observadas estuvieron asociadas con otros Cébidos, principalmente Lagothrix lagothricha. Cacajao calvus es una de las especies sometidas a una alta presión de caza, por lo tanto se encuentra en situación amenazada.
REFERENCIAS
Abordo, E., R. Mittermeier, J. Lee y P. Mason. 1975. Social grooming squirrel monkeys and Uakaris in a seminatural environment. Primates 16 (2): 217-221.
Fontaine, R. 1979. Survey of the Red Uakari (Cacajao ca1vus rubicundus) in eastern Peru. Report of the New York Zoological Society on the Project New York, USA. 18 PP.
Fontaine, R. 1981. The Uakaris, Genus Cacajao. pp. 221-240. En A.F. Coimbra-Filho y R. Mittermeier (Eds.). Ecology and Behavior of Neotropical Primates.
Freese, C., P. Heltne, N. Castro y G. Whitesides. 1982. Patterns and determinants of monkeys densities in Peru and Bolivia, with notes on distributions. Int. 1. Primatol. 3:53-90.
Mittermeier, R. y A. Coimbra-Filho. 1977. Primate Conservation in Brasilian Amazonia. En Prince Rainier of Monaco y G.H. Bourne (Eds.). Primates Conserv. Academic Press, New York.
Southwick, C. y F. Cadigan. 1972. Population
studies of Malaysian primates. Primates 13: 1-18

CENSOS POBLACIONALES Y SACAS PERIÓDICAS DE PRIMATES EN LA AMAZONIA PERUANA (1976-1985)
Julio Tapia, Filomeno Encarnación,
Rolando Aquino,Luis Moya y Pekka Soini
INTRODUCCIÓN
La similitud anatómica, fisiológica, bioquímica y etológica de los primates no humanos con el hombre, ha permitido su utilización como animales modelo para la investigación biomédica. Para tal fin desde 1976, el Proyecto Peruano de Primatología (PPP) ejecuta, para un adecuado manejo y conservación de las poblaciones de primates en su medio natural, censos y evaluaciones y sacas periódicas de 9 especies, en diferentes áreas de la Amazonía Peruana, para establecer colonias reproductoras en el Centro de Reproducción y Conservación de Primates No Humanos (CRCP) del PPP, y de exportación para la investigación biomédica.
ANTECEDENTES
Castro (1977) reporta que desde 1964 a 1974, se exportaron de Iquitos 339 080 primates de especies diferentes, de preferencia Saimiri, Saguinus, Aotus, y Cebus, seguidos de Lagothrix, Cebuella, Callicebus, Cacajao, Alouatta y Pithecia, para su utilización como mascotas y en investigaciones biomédicas. Las capturas de primates se realizaban de manera rústica como la persecución, con armas de fuego (para matar a los padres y obtener las crías), dardos impregnados con curarina y trampas colectivas. Los animales capturados eran retenidos y transportados en jaulas inadecuadas, causando altos índices de mortalidad. Posteriormente eran aglomerados en "cuarentenas" de ambientes pequeños, sin separar especies, ocasionando problemas en la salud y consecuente mortalidad. Conocedores de esta situación, Moro (1972), Soini (1972) y Castro (1977), entre otros, recomendaron tomar medidas correctivas contra la exportación indiscriminada de primates y de otras especies de fauna silvestre, y plantearon la necesidad de la utilización racional de los recursos faunísticos. En 1973, el Gobierno del Perú, declaró una veda por tiempo indefinido para la mayoría de especies de fauna de la Región de la Selva, considerando a todos los primates.
CENSOS Y EVALUACIONES POBLACIONALES
Los censos y las evaluaciones de primates en su hábitat natural constituyen las primeras acciones que nos indican los conocimientos básicos sobre las especies y el número de individuos en un área determinada para el manejo de poblaciones, y nos permiten comparar las densidades poblacionales en las diferentes cuencas de la Amazonía. El Proyecto inició los censos en 1973 en forma general, obteniendo información cualitativa y cuantitativa de las especies. A partir de 1976, fueron orientados a especies de importancia biomédica, como Saguinus spp., Saimiri spp., Aotus spp., Cebuella pygmaea y Cebus sp. Los censos se ejecutan antes y después de las capturas, para programar las mismas, determinar el grado de recuperación poblacional de 2 a 6 años después de una saca. La metodología empleada es el método de transectos, utilizada por Southwick y Cadigan (1972) en Malasia Occidental y modificada por Freese (1975) para primates neotropicales. Los Cuadros del 1 al 9, resumen los resultados de los censos realizados. Los datos anteriores a 1976 están referidos por Freese et al. (1982), Neville et al. (1976) y Soini (este volumen). El Cuadro 10 resume los resultados de los estudios sobre recuperación poblacional de Saguinus mystax en las cuencas de los Ríos Manití, Tahuayo, Yanayacu y Yarapa, mediante la aplicación de censos post-captura después de 2 a 6 años de ocurridas las sacas (Clander et al. 1984 y Ramírez 1984). Para las especies de primates que se encuentran en situación vulnerable o amenazada, se ejecutan censos con la finalidad de determinar áreas de protección como en el caso de Cacajao calvus "huapo rojo"; Aotus vociferans en los Ríos Napo y Putumayo, y Saguinus labiatus en el Departamento de Madre de Dios. Un análisis de los resultados de los censos post-captura ejecutados para determinar la recuperación poblacional, realizados de 2 a 6 años después de una saca, nos indican que probablemente la recuperación de las poblaciones está sujeta a: i) intensidad de la saca, ii) extensión de las áreas de captura, iii) composición por edad y sexo de la población remanente, iv) migración de otros grupos, v) reproducción, vi) densidad poblacional en las áreas aledañas, vil) calidad de hábitat, etc., con algunas diferencias o excepciones, como la reportada por Glander et al. (1984) en el Caserío Santa Cecilia (Río Manití), donde encontró que la población censada de Saguinus mystax y Saguinus fuscicollis había alcanzado el nivel poblacional original existente, 2 años después de la saca.
SACAS PERIÓDICAS
Saguinus mystax
Las sacas de S. mystax se realizaron a partir de 1976, empleando el método de la trampa "Saguinus" (Encarnación et al., este volumen). Los resultados obtenidos de la saca de esta especie de las áreas silvestres durante el período 1976-1985, están resumidos en el Cuadro 11. Asimismo, durante este período se identificaron tres etapas: una de experimentación o aprendizaje entre 1976 y 1977; otra de innovación y tecnificación de los métodos de atrapamiento, de 1978 a 1980; y una tercera de perfeccionamiento de los métodos y técnicas a partir de 1981. El factor mortalidad es buen indicativo de estos cambios. Así, en la primera etapa, el índice de mortalidad fue de 33 animales (4,5%), de 728 ejemplares; en la segunda fue de 61 animales (3,7%), de 1668; y en la tercera sólo 3 animales (0,4%) de 785. Además, las cuencas visitadas con fines de sacas, y su ubicación, nos ha facilitado dividir las áreas intervenidas en 3 sectores: el Sector Este, formado por la cuenca del Río Amazonas y sus tributarios Yanayacu, Manití, Orosa, Quebradas Vainilla, Cochiquinas, Pichana y Motahuayo; el Sector Central, con las cuencas de los Ríos Tamshiyacu, Tahuayo(Qda. Blanco); y el Sector Sur, la cuenca de] Río Ucayali y sus tributarios, Qdas. Chingana y Carahuaite, y los Ríos Tapiche y Yarapa. Los ejemplares sacados del Sector Este suman 2264 ejemplares (71,2%); los del Sector Central, 166 (5,2%); del Sector Sur 751 (23 6%).
Cuadro 1.- Resultados de los censos poblacionales
de Saguinus mystax, realizados a partir de 1976.
| Densidades originales |
Densidad posteriora la saca. | ||||
| Año | Cuenca | Sector | Man./km2 lnd./km2 |
Año | Man./km2 ind.lkm2 |
| 1976 |
R. Manití |
Medio | 5,0/25,0 | 5,0/29,5 | |
|
Los Angeles |
4,6123,0 |
1982 |
|||
|
1980 |
Sta. Cecilia |
. 15/8,0 |
1982 |
1,8/9,7 |
|
| 1977 | R.Tahuayo | Qda. Blanco | 6,5/32,0 | 1984 | 6,6133,2 |
|
R. Yanayacu |
Gral. Merino |
5,0/25,0 |
1984 |
11,9/72,6 |
|
|
1984 |
Bombonaje |
5, 6/32,2 |
|||
|
1978 |
R. Ucayali |
Curiyacu | 8,0/47,8 | ||
| Aucayacu | 5,4/32,2 | ||||
| Tum bo | 4,9/30,0 | ||||
|
Carahuaite |
5,3/26,5 |
||||
|
R. Yarapa |
Pto. Miguel |
6,3/32,1 |
1981 | 4,7/24,7 | |
| 1982 | 4,7/23,7 | ||||
|
1984 |
6,6/33,7 |
||||
| 1979 | R. Orosa | Sta. Ursula | 5,7/28,5 | ||
| 1982 | Paucarillo | 10,0/60,0 | |||
|
R.Cochiquinas |
Varios |
6,9L34,5 |
|||
|
1981 |
R. Pichana | Santa Isabel | 7,7/38,5 | ||
| R. Yanashi | A. Yanashi | 2 man./km orilla | |||
| R. Amazonas | Qda. Vainilla | 14,0/84,0 | |||
|
R.Tamshiyacu |
Pto. Buenos Aires |
1,4/7,0 |
|||
Cuadro 2.- Resultados de los censos poblacionales de Saguinus fuscicollis,
realizados a partir de 1976.
|
|
Densidades originales |
Densidad posterior a la saca. |
|||
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
Año |
Man./kM2 ind./km2 |
| 1976 | R. Manití | Los Angeles | 4,7/23,0 | 1982 | 3,4/24,1 |
|
1980 |
Sta. Cecilia |
1,5/10,5 | 1,2/10,8 | ||
|
1977 1984 |
R.Tahuayo | Qda. Blanco | 5,0130,0 | 1984 | 4,7/28,3 |
| R. Yanayacu |
Gral. Merino |
5,6/30,0 |
11,9/71,4 |
||
|
Bombonaje |
5,6/29,1 |
||||
| 1978 |
R. Ucayali |
Curiyacu | 7,4144,2 | ||
| Aucayacu | 4,0/24,0 | ||||
|
Tumbo |
4,9/30,0 |
||||
| 1978 | R. Yarapa | Pto. Miguel | 4,7133,0 | 1981 | 4,7 /26,0 |
| 1982 | 5,8/31,0 | ||||
|
1984 |
6,6/34,9 |
||||
| 1980 | R.Pacaya | Cahuana | 2,0/15,0 | ||
|
1981 |
R.Cochiquinas | Varios | 2,3/13,8 | ||
| R. Pichana | Sta. Isabel | 3,8/22,8 | |||
|
R. Yanashi |
A. Yanashi |
(0,2 rnan. /km orilla) |
|||
| 1982 | R. Orosa | Paucarillo | 10,0/60,0 | ||
| R. Tarnshiyacu | Pto. Buenos Aires | 2,8/16,8 | |||
|
1980 |
R. Acre | Iñapari | 4,3/26,0 | ||
| R. Yaverioa | Primavera | 3,3/19,8 | |||
| R. Noaya | Noaya | 2,2/13,5 | |||
|
Noaya(km 38) |
3,1/18,8 |
||||
|
R. Tahuamanu |
Iberia |
9,4/56,2 |
|||
Cuadro 3.- Resultados de los censos poblacionales de Saimiri boliviensis
peruviensis, realizados a partir de 1976.
| Año | Cuenca | Sector | Man./km2 má/km2 |
|
1976 |
R. Manití | Varios | 4,5/180,0 |
|
0,2/8,0 |
|||
| R. Pacaya | Varios | 0,9/ 36,0 | |
|
Cahuana |
115/ 50,0 |
||
| R. Cocama | Est. Gtmtiérrez | 0,4/ 12,5 | |
|
1980 |
R. Yaverija | Prirnavera | 0,7/19,8 |
| R. Noaya | Noaya | 0,6/17,7 | |
|
Noaya (km 38) |
0,9/26,7 |
||
| R. Tahuarríanu | Iberia | 0,4/ 12,6 | |
| 1981 | R. Cochiquinas | Varios | 1,3/52,0 |
| 1984 | R. Yarapa | Pto. Miguel | 7,7/308,0 |
|
R. Yanayacu |
Gral. Merino |
2,3/92,0 |
Cuadro 4.- Resultados de los censos poblacionales de Saimiri sciureus
macrodon, realizados a partir de 1975.
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
| 1975 | R. Amazonas | Isla Iquitos | 3,9/54,6 |
|
1976 |
2,6/ 52,0 |
||
| 1977 | R. Manití | Los Angeles | 1,1/42,9 |
|
1978 |
R. Ucayali |
Curiyacu | 0,21/11,1 |
| Aucayacu | 0,8/23,7 | ||
|
Tumbo |
0,5/ 15,9 |
||
|
1977 |
R. Nanay | Varios | 0,2/8,0 |
| R. Orosa | Varios | 0,9/36,0 | |
| R. ltaya | Varios | 1,5/60,0 | |
|
R. Samiria |
Varios |
1,8/72,0 |
|
|
1984 |
R. Amazonas |
San Pedro | 2,3/46,0 |
| Carococha | 3,7/101,0 | ||
| Sta. Cruz | 4,2/119,0 | ||
|
Sta. Zulema |
2,5/92,0 |
Saguinus fuscicollis
Las sacas de S. fuscicollis fueron realizadas simultáneamente con S. mystax, empleando la misma metodología y con la misma finalidad. Los resultados,obtenidos sobre esta especie durante el período 1977-1985, están resumidos en el Cuadro 12. Cabe señalar que por haberse realizado el atrapamiento en diferentes áreas, se ha podido identificar cinco subespecies, tales como S. f. nigrifrons, S. f. fuscicollis, S. f. illigeri, S. f. lagonotus y S. f. weddelli, las cuales fueron consideradas como S. fuscicollis para la determinación de porcentajes.
Cuadro 5.- Resultados de los censos pobladonales
de Aotus nancymai, realizados a partir de 1981.
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
| 1981 | R. Tahuayo | Punga-Huaisi | 17,0/66,3 |
|
R. Amazonas |
Cochiquinas |
13,0/50,7 |
|
| 1982 | R. Orosa | 9,0/35,1 | |
| 1984 | R. Marañón | Nucuray | 1519/48,5 |
| R. Nucuray | Pavayacu | 1117/48,0 | |
| R. Marañón | Uritoyacu | 13,2/54,2 | |
|
Chambira |
10,0/41,0 |
||
|
R- Tigre |
Tigrillo |
0,0/0,0 |
|
|
1985 |
R. Manití | Varios | 6,9/28,3 |
| R. Orosa | Varios | 6,6/27,0 | |
| R. Cochiquinas | Varios | 4,1/16,0 | |
| R. Tigre | Varios | 5,9/26,2 | |
|
R. Marañón |
Qda. Yanayacu |
9,7/39,8 |
Cuadro 6.- Resultados de los censos poblacionales de Aotus vocifemns,
realizados a partir de 1982.
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
| 1982 | R. Nanay | Pintuyacu | 3,2/14,6 |
|
Chambira |
0,5/2,0 |
||
|
1983 |
R. Napo | Sta. María | 9,0/29,7 |
| Qda. Aushiri | 2,2/7,26 | ||
|
Curaray |
8,0/26,4 |
||
| 1984 | R. Napo | Tambor | 5,0/16,5 |
|
Varios |
8,0/26,4 |
||
| 1985 | R- Ampiyacu | Varios | 5,9/19,6 |
| L Apayacu | Varios | 3,5/11,5 | |
|
R. Tigre |
Varios |
2,2/7,3 |
Cuadro 7.- Resultados de los censos poblacionales de Cebus apella, realizados
a partir de 1980.
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
|
1980 |
R. Acre | Iñapari | 0,5/ 3,7 |
| R. Yaverija | Primavera | 1,2/9,7 | |
| R. Noaya | Noaya | 1,3/10,2 | |
|
Noaya (km 38) |
1,4/11,2 |
||
|
1982 |
R. Pacaya | Cahuana | 1,0/9,0 |
| R. Sarniria | E.B.Pithecia | 3,9/20,0 | |
|
2,9/29,0 |
Cuadro 8.- Resultados de los censos poblacionales
de Cebuella pygmaea, realizados a partir de 1976.
| Año | Cuenca | Sector | Man./Km2 ind./km2 |
| 1977 | R. Manití | Los Angeles | 12,5/51,5 |
| 1978 | R- Manití | Los Angeles | 11,5/59,0 |
Cuadro 9.- Resultados de los censos poblacionáes de Saguinus labíatus
(Dpto. Madre de Dios).
|
Año |
Cuenca |
Sector |
Man./km2 ind./km2 |
|
1980 |
R. Acre | Iñapari | 2,5/14,9 |
|
R. Yaverija |
Primavera | 3.3/19,8 | |
| Noaya | 0,3/1,7 | ||
|
Noaya (km 38) |
3,1/18,8 |
||
| R. Tahuamanu | Iberia | 3,4/20,4 |
Cuadro 10.- Recuperación poblacional
de S. mystax y S. fuscicollis. Resultados de los censos (ind./km2) realizados
2-6 años después de las sacas.
|
Densidad original |
Años después de la saca |
||||
|
2 |
3 |
4 |
5 |
6 |
||
|
||||||
|
23,0 | - | - | - | 29,5 | - |
|
8,0 | 9,7 | - | - | - | - |
|
25,0 |
- |
- |
- |
- |
72,6 |
|
32,0 | - | - | - | - | 33,2 |
|
32,1 | 24,7 | 23,7 | - | 33,7 | - |
|
||||||
|
23,0 | - | - | - | 24,1 | - |
|
10,5 | 10,8 | - | - | - | - |
|
30,0 | - | - | - | - | 71,4 |
|
30,0 | - | - | - | - | 28,3 |
|
33,0 | 26,0 | 31,0 | - | 34,9 | - |
Las etapas y los sectores identificados para S. mystax son los mismos para S fuscicollis. La mortalidad de ambas especies fue por estrés y "tembladera" (síndrome consuntivo).
Cuadro 11.- Sacas de Saguinus mystax
(1976-1985).
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
| (Río) |
N° |
N° |
N° | % | N° | % | N° | % |
CRCP |
% |
|
|
1976 |
|||||||||||
|
Set-Dic. |
Manití |
56 |
264 |
18 |
(6,8) |
40 |
(15,1) |
- |
- | 206 | |
|
TOTAL ANUAL: |
, |
56 |
264 |
18 |
- |
40 |
- |
- |
- |
206 | |
|
1977 |
|||||||||||
|
Ene-Feb. |
Manití |
29 |
122 |
- |
- | - | - |
- |
- |
122 |
|
|
Jul-Nov. |
Yanayacu |
49 |
176 |
2 |
(1,13) | - |
- |
2 |
(1,13) |
172 |
|
|
Jul-Oct. |
Tahuayo |
24 |
102 |
11 |
(10,8) |
9* |
(818) |
1 |
(0,10) | 8 | |
|
Ago-Oct. |
Tarrishiyacu |
11 |
46 |
1 |
(2,2) |
2* |
(4,4) |
- |
- | 43 | |
|
Jul-Dic |
Tahuayo |
5 |
18 |
1 |
(5,6) |
1 |
(5,6) |
- |
- | 16 | |
|
TOTAL ANUAL: |
118 |
464 |
15 |
12 |
3 |
- |
- | - | - | 434 | |
|
1978 |
|||||||||||
|
Jun-Dic. |
Carahuaite |
51 |
219 |
7 |
(3,2) |
- |
- |
2 |
(1,0) |
210 |
|
|
Jun-Oct. |
Yarapa |
60 |
226 |
8 |
(3,5) |
1 |
(015) |
2 |
(1,0) |
215 |
|
|
Jun-Nov. |
Tapiche |
30 |
169 |
7 |
(4,1) |
3 |
(1,8) |
2 |
(1,2) |
157 |
|
|
Nov-Dic. |
Amazonas |
4 |
19 |
2 |
(10,5) |
17* |
(89,5) |
- |
- |
- |
|
|
TOTAL ANUAL: |
145 |
633 |
24 |
21 |
6 |
- |
- |
- | - | 582 | |
|
1979 |
|||||||||||
|
Jul-Dic. |
Orosa |
124 |
519 |
27 |
(5,2)- |
- | - |
6 |
(12) |
486 |
|
|
TOTAL ANUAL |
124 |
519 |
27 |
- |
6 |
- |
- |
- | - | 486 | |
|
1980 |
|||||||||||
|
May, 80 |
|||||||||||
|
Feb. 81 |
Manití |
76 |
393 |
8 |
(2,0) |
28* | (7,1) |
3 |
(0,8) |
354 |
|
|
Set-Oct. |
Amazonas |
? |
123 |
2 |
(1,6) |
37 | (30,1) |
- |
- |
84 |
|
|
TOTAL ANUAL: |
, |
516 |
10 |
65 |
3 |
- |
- |
- | - | 438 | |
|
1981 |
|||||||||||
|
Ago-Oct. |
Amazonas |
? |
162 |
1 |
(0,6) |
- | - |
1 |
(0,6) |
160 |
|
|
TOTAL ANUAL: |
, |
162 |
1 |
- | - | - |
- |
- | 160 | ||
|
1982 |
|||||||||||
|
Jun-Oct. |
Orosa |
31 |
142 |
1 |
(0,7) |
- | - |
-
|
- | 141 | |
|
Jun-Oct. |
Matahuayo |
11 |
64 |
- |
- | - | - |
- |
- | 64 | |
|
Jun-Oct. |
Vainilla |
4 |
22 |
1 |
(4,5) |
- | - |
-
|
- | 21 | |
|
TOTAL ANUAT.: |
, |
46 |
228 |
2 |
- | - | - |
- |
- | 226 | |
|
1983 |
|||||||||||
|
Set-Nov. |
Manití |
25 |
111 |
- |
- | - | - |
- |
- | 111 | |
|
TOTAL ANUAL: |
, |
25 |
111 |
- |
- | - | - |
- |
- | 111 | |
|
1984 |
|||||||||||
|
Ago-Oct. |
Yanayacu |
40 |
147 |
- |
- | - | - | - | - |
147 |
|
|
TOTAL ANUAL: |
, |
40 |
147 |
- | - | - | - | - | - |
147 |
|
|
1985 |
|||||||||||
|
Set-Dic. |
Chingana |
31 |
137 |
- |
- |
19 | (13,9) | - | - |
118 |
|
|
TOTAL ANUAL: |
, |
31 |
137 |
- |
19 | - | - | - |
118 |
||
| TOTAL | 3181 | 97 | (3,1) | 157 | (4,9) | 19 | (0,6) | 2908 | (91,4) | ||
* Ejemplares Ilberades en Padre Isla para el Programa de Crianza en Semicautiverio.
Cuadro 12.- Sacas de Saguinus fuscicollis
(1977-1985)
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
|
(Río) |
N° |
N° |
N° |
% |
N° |
% |
N° |
% |
CRCP |
% |
|
| Saguinus tuscicoffis nigrifrons | |||||||||||
| 1977 | |||||||||||
| jtml-Nov. | Yanayacu | 19 | 58 | 6 | (10,3) | 11 | (19,0) | 41 | |||
| Jul-Oct. | Tahuayo | 24 | 102 | 11 | (10,8) | 9 | (8,8) | 1 | (1,0) | 81 | |
| Ago- Oct. | Tamshiyacu | 4 | 19 | 6 | (31,6) | - | 13 | ||||
| Julio-Dic. |
Tahuayo |
5 |
18 |
1 |
(5,6) |
1 |
(5,6) |
16 |
|||
|
TOTAL ANUAL: |
52 | 197 | 24 | 21 | 1 | 151 | |||||
| 1978 | |||||||||||
| jun-Oct. | Yarapa | 16 | 88 | 13 | (14,8) | 7 | (8,0) | 2 | (2,3) | 66 | |
| jun-Dic. | Carahuaite | 29 | 120 | 29 | (24,2) | - | - | 3 | (2,5) | 88 | |
| jun-Nov. | Tapiche | ? | 75 | 9 | (12,0) | -
|
- | 13 | (17,3) | 53 | |
| TOTAL ANUAL: | , | ? | 283 | 51 | 7 | 18 | 207 | ||||
| 1979 | |||||||||||
| jul-Dic. | Orosa | 51 | 222 | 17 | (7,7) | - | - | 6 | (2,7) | 199 | |
| TOTAL ANUAL: | , | 51 | 222 | 17 | 6 | 199 | |||||
| 1980 | |||||||||||
| May. 80 | |||||||||||
| Feb. 81 | Manití | 40 | 186 | 24 | (12,9) | 4 | (2,2) | 5 | (2,7) | 153 | |
| Set-Oct. | Amazonas | ? | 39 | - | - | - | - | - | - | 39 | |
| TOTAL ANUAL: | , | ? | 225 | 24 | 4 | 5 | 192 | ||||
| 1982 | |||||||||||
| jun-Oct. | Orosa | 3 | 12 | - | - | - | - | - | - | 12 | |
| TOTAL ANUAL: | , | 3 | 12 | 12 | |||||||
| 1983 | |||||||||||
| Set-Nov. | Manití | 4 | 12 | 12 | |||||||
| TOTAL ANUAL: | , | 4 | 12 | 12 | |||||||
| 1985 | |||||||||||
| Oct-Dic. | Chingana | 29 | 48 | 8 | (16,7 ) | 40 | |||||
| TOTAL ANUAL: |
|
29 | 48 | - | 8 | 40 | |||||
|
Saguinus fuscicortis fuscicollis |
|||||||||||
| 1978 | |||||||||||
| Jul-Nov. | Tapiche | ? | 29 | 7 | (24,1) | 5 | (17,3) | 17 | |||
| TOTAL ANUAL: | , | ? | 29 | 7 | - | 5 | 17 | ||||
|
Saguinus fuscicollis illigen |
|||||||||||
| 1978 | |||||||||||
| jun-Nov. | Tapiche | ? | 23 | 8 | (34,8) | 7 | (30,4) | 8 | |||
| Set-Nov. | Yucuruche | 1 | 1 | 1 | |||||||
| TOTAL ANUAL: | ? | 24 | 8 | , | , | , | 7 | 9 | |||
|
Saguinus fuscicollis lagonolus |
|||||||||||
| 1978 | |||||||||||
| Set-Nov. | Tahuayo | 3 | 5 | 3 | (60,0) | 2 | |||||
| TOTAL ANUAL: | , | 3 | 5 | 3 | 2 | ||||||
|
Saguinus fuscicollis wedddli |
|||||||||||
| 1979 | |||||||||||
| Set-Nov. | Madre de Dios | 1 | 3 | 3 | |||||||
| TOTAL ANUAL: | , | 1 | 3 | 3 | |||||||
| TOTALES: | 1060 | 134 | (12,6) | 40 | (3,8) | 42 | (4,0) | 844 | (79,6) | ||
Saimiri boliviensis peruviensis
Las sacas de Saimiri boliviensis peruviensis se realizaron a partir de 1977, exclusivamente en el Sector Sur (Río Ucayali), y el Sector Sur-Oeste, en el Río Marañón. La metodología empleada fue el "Arreo y Aislamiento" (Tapia et al., este volumen). Los resultados obtenidos en las sacas durante el período 1977-1985, están resumidos en el Cuadro 13. Durante el período transcurrido entre sesiones de atrapamiento, no se definió ninguna etapa porque desde sus inicios se utilizó la metodología adecuada con algunas innovaciones posteriores.
Cuadro 13.- Sacas de Saimiri boliviensis
peruviensis (1977-1985)
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
| (Río) |
N° |
N° |
N° | % |
N° |
% |
N° |
% |
CRCP |
% |
|
| 1977 | |||||||||||
| Mar-Abr. | Pacaya | 19 | 642 | 26 | «~1) | - | - | 616 | |||
| Jul-Dic. | Amazonas-Marañón | 13 | 371 | 4 | (1,1) | 59 | (16,0) | - | - | 308 | |
| TOTAL ANUAL: | , | 32 | 1013 | 30 | 59 | - | - | 924 | |||
| 1978 | |||||||||||
| Set-Nov. | Yarapa-Ucayali Marañón Tahuayo |
7 |
139 |
13 |
(9,4) |
23 |
(16,6) |
- |
- |
103 |
|
| TOTAL ANUAL: | , | 7 | 139 | 13 | , | 23 | - | - | - | 103 | |
| 1980 | |||||||||||
| Set-Oct | Amazonas | 1 | 4 | - | - | - | - | - | - | 4 | |
| TOTAL ANUAL: | , | 1 | 4 | - | - | - | - | - | - | 4 | |
| 1981 | |||||||||||
| Jul-Ago. | Marañon | 5 | 225 | 6 | (2,7) | 74 | (32,9) | 145 | |||
| TOTAL ANUAL: | 5 | 225 | 6 | , | 74 | - | - | , | 145 | ||
| 1983 | |||||||||||
| Set. | Marañón | 2 | 40 | - | - | - | - | - | 40 | ||
| TOTAL ANUAI- | , | 2 | 40 | - | - | - | - | - | - | 40 | |
| 1984 | |||||||||||
| May-jun. | Amazonas | ? | 80 | - | - | - | - | - | - | 80 | |
| TOTAL ANUAL. | , | ? | 80 | - | - | - | - | - | - | 80 | |
| 1985 | |||||||||||
| jui-Ago. | Marañón | 11 | 364 | 8 | (2,2) | 8 | (2,2) | 2 | (0,5) | 346 | |
| TOTAL ANUAL: | , | 11 | 364 | 8 | 8 | 2 | 346 | ||||
| TOTAL: | 1865 | 57 | (3,1) | 164 | (8,8) | 2 | (0,1) | 1642 | (88.0) | ||
* Saimiri sciureus macrodon
La saca de esta especie se inició en 1978 en la margen izquierda del Río Amazonas, luego el Marañón y ambas márgenes del Río Nanay. En la confluencia de los Ríos Ucayali-Marañón (Río Yarapa) fueron atrapados 11 ejemplares con fenotipo correspondiente al "arco gótico"; sin embargo algunos presentaban afinidad al "arco romano" (Encarnación 1980). Se utilizó la misma metodología de la especie anterior. Los resultados de la saca durante el período 1978-1984, se resumen en el Cuadro 14. En este caso tampoco se definieron etapas, por la razón indicada para la especie anterior. La mortalidad para ambos sexos se debió a agresiones y por asfixia de ejemplares juveniles y crías cuando éstos se aglomeraban al sentirse cautivos.
El mayor registro de muertes ocurrió en 1978, a causa de un naufragio del bote que transportaba 40 animales del lugar de atrapamiento al campamento de retención, donde murieron 33, llevando el índice de mortalidad a 40,7% de un total de 81 ejemplares atrapados.
Cuadro 14.- Sacas de Saimiri sciureus
macrodon (1978-1984)
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
| (Río) |
N° |
N° |
N° | % |
N° |
% |
N° |
% |
CRCP |
% |
|
| 1978 | 1 | ||||||||||
| Set-Nov. | Amazonas y Marañon |
5 | 81 | 33* | (40,7) | 4 | (5,0) | - | 44 | ||
| TOTAL ANUAL- | , | 5 | 81 | 33 | - | 4 | - | - | - | 44 | |
| 1979 | |||||||||||
| Jul-set. | Amazonas y Marañón |
14 | 312 | 16 | (5,1) | - | - | - | - | 296 | |
| TOTAL ANUAL: | , | 14 | 312 | 16 | - | - | - | - | - | 296 | |
| 1981 | |||||||||||
| Abr-Jun. | Nanay | 8 | 185 | 1 | (0,5) | 40 | (21,6) | - | - | 144 | |
| Set-Oct. | Marañón | 5 | 126 | 2 | (1,6) | 14 | (11,1) | - | - | 110 | |
| TOTAL ANUAL: | , | 13 | 311 | 3 | - | 54 | - | - | - | 254 | |
| 1983 | |||||||||||
| Set. | Marañon | 3 | 52 | 52 | |||||||
| TOTAL ANUAL: | , | 3 | 52 | 52 | |||||||
| 1984 | |||||||||||
| May-Jul. | Amazonas | ? | 47 | - | 47 | ||||||
| Ago-Set. | Isla Iquitos | ? | 10 | - | 10 | ||||||
| TOTAL ANUAL: | , | ? | 57 | 57 | |||||||
| T 0 T A L: | 813 | 52 | (6,4) | 58 | (7,1) | 703 | (86,5) | ||||
* Mortalidad producida por naufragio durante operación de transporte.
Aotus nancymai
Las sacas de A. nancymai fueron iniciadas en 1978 en el Río Tahuayo, utilizando el método del "Aislamiento del nido o madriguera" (Tapia et al., este volumen). Los resultados de esta saca se resumen en el Cuadro 15. En relación a las especies anteriores, esta saca es laboriosa por los hábitos nocturnos de este primate. Entre 1978-1983, se definieron dos etapas, la de aprendizaje (1978-1979) y la de innovación (1981-1985). La primera se caracteriza por una elevada mortalidad ocurrida en la cuenca del Río Yanayacu (afluente derecho del Río Amazonas), al haberse utilizado para la captura una cerbatana de origen Jíbaro con dardos impregnados de "ampi", que es un veneno producto de la mezcla de curarina, sustancia obtenida de la raíz del Chondodendrum tomentosum "curare" (Menispermaceae), con otra obtenida de las hojas de Psychothria sp. "chachruna" (Rubiaceae) y una batracotoxina obtenida por trituración total de un pequeño batracio (de la familia Dendrobatidae). " acción de la curarina es principalmente el bloqueo neuromuscular, produciendo un relajamiento del tono muscular (flacidez) y que en dosis no adecuadas produce muerte por paro cardiaco (Rossoff 1974). La mortalidad en mención se produjo debido a la falta de una dosificación adecuada del -ampi".
Cuadro 15.- Sacas de Aotus nancymai (1978-1985).
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
|||
|
(Río) |
N° |
N° |
N° |
% |
N° | % |
N° |
CRCP |
% |
|
| 1978 | ||||||||||
| DIc. | Carahuaite | 1 | 2 | - | - | - | - | - | 2 | |
| Oct-Nov. | Tahuayo | 6 | 16 | 5 | (31,2) | - | - | - | 11 | |
| TOTAL ANUAL: | , | 7 | 18 | 5 | ; | - | - | - | 13 | |
| 1979 | - | - | - | |||||||
| Feb-May. | Yanayacu | 13 | 23 | 10 | (43,5) | - | - | - | 13 | |
| TOTAL ANUAL: | , | 13 | 23 | 10 | - | - | - | 13 | ||
| 1981 | - | - | - | |||||||
| Abr-Jun. | Tahuayo | 38 | 101 | 1 | (1,0) | 1 | (1,0) | 99 | ||
| TOTAL ANUAL: | , | 38 | 101 | 1 | - | 1 | - | 99 | ||
| 1984 | - | - | - | |||||||
| Abr. | Tahuayo | 18 | 63 | 1 | (1,6) | - | - | - | 62 | |
| Set-Nov. | Tahuayo | 55 | 124 | - | - | - | 124 | |||
| TOTAL ANUAL: | , | 73 | 187 | 1 | - | - | - | 186 | ||
| 1985 | - | - | - | |||||||
| Jul-Dic. | Amazonas | 15 | 43 | - | - | - | - | 43 | ||
| Tahuayo | - | - | - | |||||||
| Jul-Dic. | Marañón | 28 | 75 | 3 | (4,0) | - | - | - | 72 | |
| Abr-jun. | Amazonas | 52 | 155 | 4 | (2,6) | 1 | - | (0,6) | 150 | |
| TOTAL ANUAL: |
95 |
273 | 7 | - | - | 1 | - | 265 | ||
| T 0 T A L: | 602 | 24 | (4,0) | - | 2 | (0,3) | 576 | (95,7) | ||
Aotus vociferans
La saca de esta especie se inició en 1982, en el Río Nanay, y se continuó en los Ríos Napo y Yanayacu. Los resultados están resumidos en el Cuadro 16. El área más intervenida fue la del Río Napo. Tanto A. vociferans como A. nancymai fueron capturados con la finalidad de establecer una colonia de reproducción en el CRCP, y exportación para estudios de Malaria.
Cebuella pygmaea
Las sacas de C. pygmaea fueron iniciadas en 1977 y continuaron hasta 1983. La metodología de saca fue la empleada para Saguinus. Por los resultados obtenidos de la saca que se resumen en el Cuadro 17, durante este período, se diferencian también dos etapas: la de aprendizaje y experimentación, y la de perfeccionamiento. Las áreas de saca fueron las mismas donde se capturaron Saguinus sp. El Río Orosa, aparte de ser el área de mayor saca, también fue el lugar donde ocurrió el mayor índice de mortalidad por estrés, con 26 animales.
Cuadro 16.- Sacas de Aotus vociferans (1982-1984).
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
| (Río) | N° | N° |
N° |
% | N° | % | N° |
% |
CRCP |
% |
|
| 1982 | |||||||||||
| Set-Nov. | Nanay | 16 | 13 | 1 | (7,7) | - | - | - | - | 12 | |
| TOTAL ANUAL: | , | 16 | 13 | 1 | - | - | - | - | 12 | , | |
| 1983 | - | - | |||||||||
| Ene-Feb. | Napo | 3 | 8 | - | - | - | - | - | - | 8 | |
| May-Jun. | Napo | 8 | 18 | 1 | (5,6) | - | - | - | - | 17 | |
| Ago-Set. | Nanay | 12 | 29 | 2 | (6,9) | - | - | - | - | 27 | |
| Nov-Dic. | Napo | 13 | 34 | - | - | - | - | - | - | 34 | |
| TOTAL ANUAL: | , | 36 | 89 | 3 | - | - | - | - | - | 86 | , |
|
1984 |
|
||||||||||
| Ene-Feb. | Tambor | 7 | 19 | - | - | - | - | - | - | 19 | |
| Feb-Mar. | Yanayacu | 11 | 27 | - | - | - | - | - | - | 27 | |
| Set-Oct. | Nanay | 9 | 25 | - | - | - | - | - | - | 25 | |
| TOTAL ANUAL: | 27 | 71 | - | - | - | - | - | - | 71 | , | |
| T OT A L: | 79 | 173 | 4 | (2,3) | 169 | (97,7) | |||||
Saguinus labiatus
La saca de S. labiatus se realizó en 1979 en el Dpto. de Madre de Dios, entre las localidades de Iberia e Iñapari. Se atraparon 83 ejemplares, los que fueron remitidos a Iquitos. La metodología empleada fue la misma que para S. mystax. Los resultados de la saca se resumen en el Cuadro 18.
Cuadro 17.- Sacas de Cebuella pygmaea
(1977-1983)
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
|
(Río) |
N° |
N° |
N° |
% |
N° |
% |
N° |
% |
CRCP |
% |
|
| 1977 | |||||||||||
| Jul-Nov. | Yanayacu | 3 | 14 | 2 | (14,M) | 12 | |||||
| Jui-Dic. | Tahuayo | 1 | 5 | 2 | (40,0) | 3 | |||||
| TOTAL ANUAL: | , | 4 | 19 | 2 | - | - | , | 2 | 15 | ||
| Nov. | Tapiche | 3 | 21 | - | - | 1 | (4,8) | - | - | 20 | |
|
Díc. |
Manití |
6 |
23 |
1 |
(4,4) |
- | - | - | - |
22 |
|
| Ago-Set. | Yarapa | 2 | 4 | - | - | - | - | - | - | 4 | |
| Oct. | Amazonas | 1 | 5 | - | - | - | - | - | - | 5 | |
| Dic. | Padre Isla | 1 | 1 | - | - | - | - | - | - | 1 | |
| TOTAL ANUAL: | , | 13 | 54 | 1 | - | 1 | - | - | - | 52 | |
| 1979 | |||||||||||
| Ene-Feb. | Manití | 22 | 99 | - | - | - | - | - | - | 99 | |
| Jul-Dic. | Orosa | 22 | 118 | 26 | (22,0) | 11 | (9,3) | 19 | (16,1) | 62 | |
| TOTAL ANUAI: | , | 44 | 217 | 26 | 11 | 19 | 161 | ||||
|
1980 |
|||||||||||
| Oct.80 Ene.81 |
Manití |
? |
60 |
5 |
(8,3) |
- | - |
1 |
(1,7) |
54 |
|
| TOTAL ANUAL: | , | ? | 60 | 5 | , | 1 | 54 | ||||
| Oct-Dir. | Manití | 41 | - | - | - | - | - | - | 41 | ||
| TOTAL ANUAL: | , | , | 41 | - | - | - | - | - | - | 41 | |
| T 0 T A L: | ? | 391 | 34 | (8,7) | 12 | (3,1) | 22 | (5,6) | 323 | (82,6) | |
Cuadro 18.- Saca de Saguinus labiatus (1979).
|
Período |
Procedencía |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
|
(Río) |
N° |
N° |
N° |
% |
N° |
% |
N° |
% |
CRCP |
% |
|
| 1979 | |||||||||||
| Set-Nov | Madre de Dios | 16 | 83 | - | - | - | - | - | - | 83 | |
| TOTAL ANUAL | 16 | 83 | - | - | - | - | - | - | 83 | (100,0) | |
Cebus apella
La saca de esta especie (Cuadro 19), se realizó en la cuenca del Río Samiria en 1984, se obtuvo sólo 5 ejemplares. No ocurrieron casos de muertes, liberaciones ni fugas. La metodología empleada fue la trampa "Saguinus" modificada (Tapia et al., este volumen).
Finalmente, el Cuadro 20 resume los resultados de las sacas realizadas durante el período 1976-1985.
Cuadro 19.- Saca de Cebus apella (1984).
|
Período |
Procedencia |
N° Manadas |
Población |
Muertos |
Liberados |
Fugados |
Enviados |
||||
|
(Río) |
N° |
N° |
N° |
% |
N° |
% |
N° |
% |
CRCP |
% |
|
| 1984 |
|||||||||||
| Enero-Feb. | Samiria | 5 | |||||||||
| TOTAL ANUAL | 1 | 5 | - | - | - | - | - | - | 5 | (100,0) | |
REFERENCIAS
Castro, N. 1977. Lineamientos para la conservación de primates en el Perú. En Primera Conferencia Interamericana sobre la Conservación y Utilización de Primates Ame, nos No Humanos en las Investigaciones Biomédicas. (Lima, Perú, 2 - 4 jun. 1975). OPS, Wash., D.C. Publ. Cient. 317: 228 - 247.
Encarnación, F., L. Moya, P. Soini, J. Tapia y R. Aquino. (este volumen). La captura de Callitrichidae (Saguinus y Cebuella) en la Amazonía Peruana.
Freese, C. 1975. Final Report. A census of nonhuman primates in Peru. PAHO, Wash., D.C. 42 pp.
Freese, C., P. Heltne, N. Castro y G. Whitesides. 1982. Patterns and determinants of monkey densities in Peru and Bolivia, with notes on distributions. Int. 1. Primatol. 3 -.53-90.
Glander, K., J. Tapia y A. Fachín 1984. The impact of cropping on wild populations of Saguinus mystax and Saguinus fuscicollis in Peru. Amer. J. Primatol. 7: 8997.
Moro, M. 1972. La fauna amazónica como un recurso natural. IVITA, Universidad Nacional Mayor de San Marcos, Bol. Div. 12: 1-32
Neville, M., N. Castro, A. Mármol y J. Revilla. 1976. Censusing primate populations in the reserved Area of the Pacaya and Samiria rivers, Department Loreto, Peru. Primates 17: 151-181.
Ramírez, M. 1984. Population recovery in the moustached tamarin (Saguinus mystax): Management strategies and mechanisms of recovery. Anter. J. Primatol. 7: 245259.
Rossoff, 1. 1974. Handbook of veterinary drugs. A compendium for research and clinical use. Springer Publishing Company.
Soini, P. 1972. The capture and commerce of live monkeys in the amazonian region of Peru. Int. Zoo. Yearb. 12: 26-36.
Soini, P. (este volumen). Resultados de una investigación preliminar de la fauna de la Isla de Iquitos e islas adyacentes.
Southwick, C. y F. Cadigan. 1972. Population studies of Malaysian primates. Primates 13: 1-18.
Tapia, J., R. Aquino, F. Encarnación
y L. Moya. (este volumen). Métodos y técnicas de atrapamiento
de Cébidos (Saimiri, Aotus y Cebus).
Cuadro 20.- Resumen de la saca total de Primates No Humanos en la Amazonía
Peruana (Período 1976 - 1985)
| Año | 1 | 2 | ||||||||||
| Taxón | 1976 | 1977 | 1978 | 1979 | 1980 | 1981 | 1982 | 1983 | 1984 | 1985 | Total Cosechado | Total Enviado CRCP (vivos) |
| Saguinus mystax mystax | 264 | 464 | 633 | 519 | 516 | 162 | 228 | 111 | 147 | 137 | 3181 | 2908 |
| Saguinus labíatus labiatus |
- |
- |
- |
83 |
- |
- |
- |
- |
- |
- |
83 |
83 |
| Saguinus fuscicollis nigrifrons | - | 197 | 283 | 222 | 225 | - | 12 | 12 | - | 48 | 999 | 813 |
| Saguinus fuscicollis lagonotus | - |
- |
5 | - | - | - | - | - | - | - | 5 | 2 |
| Saguinus fuscicollis illigeri | - | - | 24 | - | - | - | - | - | 5 | - | 24 | 9 |
| Saguinus Ifuscicollis fuscicollis | - | - | 29 | - | - | - | - | - | - | - | 29 | 17 |
| Saguinus fuscicollis weddellí | - | - | - | 3 | - | - | - | - | - | - | 3 | 3 |
| Cebuella pygmaea | - | 19 | 54 | 217 | 60 | - | - | 41 | - | - | 391 | 323 |
| Saimiri sciureus macrodon | - | - | 81 | 312 | - | 311 | - | 52 | 57 | - | 813 | 703 |
| Saimiri boliviensis peruviensis | - | 1013 | 139 | - | 4 | 225 | - | 40 | 80 | 364 | 1865 | 1642 |
| Aotus nancymai | - | - | 18 | 23 | - | 101 | - | - | 187 | 273 | 602 | 576 |
| Aotus vociferans | - | - | - | - | - | - | 13 | 89 | 71 | - | 173 | 169 |
| Cebus apella macrocephalus | - | - | - | - | - | - | - | - | 5 | - | 5 | 5 |
| Total: | 264 | 1693 | 1266 |
1379 |
805 | 799 | 253 | 345 | 547 | 822 | 8173 | 7253 |
La diferencia entre las cifras de las columnas 1 y 2, comprende los anímales muertos, fugados y liberados.

LA IMPORTANCIA DE LOS FRUTOS EN LA DIETA DE Saguinus mystax y S. Fuscicollis (PRIMATES, CALLITRICHIDAE), EN EL RIO TAHUAYO, DEPARTAMENTO DE LORETO, PERU
(Compendio de la Tesis para optar el Título de Biólogo, Universidad Nacional de la Amazonía Peruana Iquitos, Perú,1987).
Tula C. Fang
INTRODUCCIÓN
Las especies de primates que viven en las sabanas (tierra con vegetación herbácea), como por ejemplo Papio anubis y Papio cynocephalus, tienden a alimentarse casi exclusivamente de hojas y presentan hábitos marcadamente graminívoros (Dunbar y Dunbar 1979, Post 1981). Pero las especies de primates que viven en los bosques tropicales de Africa, América y Asia, como por ejemplo Colobus guereza, Ateles paniscus y Saguinus spp., tienden a alimentarse de una variedad más amplia de recursos vegetales (frutos, exudado, néctar y hojas) y, además, incluyen en la dicta presas animales (Bauchop 1978, Sussman 1979, Richard 1979, Klein y Klein 1979; Soini, este volumen). Esto podría indicar que el tipo de hábitat (bosques tropicales o sabanas) juegan un rol importante en la variación de la dieta alimenticia de las diferentes especies de primates.
El propósito de este estudio es determinar el tipo de alimentación de Saguinus mystax y Saguinus fuscicollis en la Quebrada Blanco (Río Tahuayo), tratando de comparar con estudios realizados sobre estas mismas especies en otras áreas.
DESCRIPCIÓN DEL ÁREA DE ESTUDIO Y MÉTODOS
El área de estudio está localizada en la Quebrada Blanco (73"04'0 y 40 15' S), tributario del Río Tahuayo, situado al Sur Este de Iquitos, Perú. Esta quebrada es de aguas blancas y de aproximadamente 45 km. de longitud. El área de estudio consiste de 45 ha, dividida por un sistema de transectos en cuadrantes de 100 x 100 m. Es una zona de tierra firme. La vegetación predominante está conformada por las familias Leguminosae, Sapotaceae, Rubiaceae, Melastomataceae y Chrysobalanaceae (Fig. l).
Los datos fueron obtenidos de un grupo mixto ¿le S. mystax y S. fuscícol7is; no capturado, seguido y observado en estado natural desde una distancia prudente. El período de estudio total comprendió desde Marzo 1984 hasta Julio 1985.
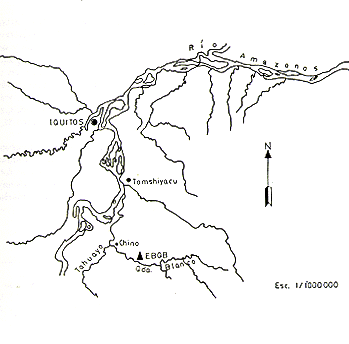
Fig. 1. - Ubicación del área
de estudio (EBQB) en la Quebrada Blanco
(Río Tahuayo)
Información sobre la ecología alimenticia, descanso, desplazamiento, uso del espacio y otras actividades diarias se registraron por observación directa de los animales y usando la técnica de punto de muestra cada 2 minutos. El grupo mixto fue observado durante 4 días cada semana. Los seguimiento eran desde que salían de su árbol de dormir hasta el retorno al árbol de dormir. La información sobre las características de los frutos se obtuvo anotando el tamaño, peso y color de los frutos consumidos por S. mystax y S. fuscicollis, para lo cual se utilizó un calibrador y una balanza CENCE. Los datos fenológicos de la fructificación se obtuvieron realizando observaciones semanales de determinadas plantas alimenticias. Los datos de frutos dispersados por Saguinus fueron obtenidos por colección y análisis de las heces de los animales.
RESULTADOS
Composición de grupo y organización social
En base a los conteos completos de animales a la salida y entrada al árbol de dormir, podemos afirmar que el grupo mixto de estudio de S. mystax y S. fuscicollis estuvo compuesto de un total máximo de 14 individuos y un número de 8 individuos de locomoción independiente, más una cría cargada. El grupo mixto de estudio demostró tener fluctuaciones temporales en el número de individuos. Por ejemplo, cuando empezamos la investigación (Febrero 1985) el grupo S. mystax estuvo compuesto por 6 individuos, y el grupo S. fuscicollis por 8 individuos. Al finalizar el estudio (julio 1985), el grupo S. mystax estaba integrado solamente por 3 individuos (Cuadro l).
Estas fluctuaciones probablemente ocurrían porque algunos individuos abandonaban la manada temporalmente (días o semanas) y se incorporaban a ella nuevamente después de este período. El grupo S. mystax estuvo formado básicamente por 2 machos adultos y 1-2 hembras (adulta y subadulta). El grupo S. fuscicollis estuvo formado por 1 hembra reproductora, 1 macho adulto (macho dominante), 1 macho subadulto, 2 juveniles (hembra y macho) y una cría cargada.
Cuadro 1.- Composición mensual del grupo
mixto de estudio
|
Variación mensual |
S. mystax |
S. fuscicollis |
||
|
Mínimo |
Máximo |
Mínimo |
Máximo |
|
| Feb-85 | - | - | - | - |
| Mar-85 | 4 | 6 | 6 | 8 |
| Abr-85 | 4 | 4 | 7 | 7 |
| May-85 | 4 | 4 | 5 | 7 |
| Jun-85 | 4 | 4 | 5 | 6 |
| Jul-85 | 3 | 3 | 6 | 6 |
| Ago-85 | 3 | 3 | 6 | 6 |
Interpretación de la actividad diaria (patrón de actividades)
Durante un muestreo de 6 meses (Febrero-julio 1985) las diferentes actividades de S. mystax estuvieron distribuidas de la siguiente manera: alimentación 17,2%, caza de insectos 5,3%, desplazamiento 16,5%, viajes 8,2%, descanso y despioje social 52,5%. La distribución de las actividades de S. fuscicollis fue en la siguiente proporción: alimentación 22,4%, búsqueda de insectos 6,6%, desplazamiento 19,0%, viajes 11,3%, descanso y despioje social 40,4%.
S. mystax y S. fuscicollis dedicaron el mayor porcentaje de tiempo al descanso (entre el 40-50% del tiempo de actividades) y el menor porcentaje de tiempo a la búsqueda de insectos. Las actividades de alimentación, desplazamiento y viajes alcanzaron porcentajes menores de 22% en ambas especies de Saguinus.
Consideramos 2 tipos de movimiento, desplazamiento y viajes. Desplazamiento implica los movimientos a distancias menores de 20 m; cuando las distancias recorridas por Saguinus fueron de 20 m a más lo consideramos como viajes. El desplazamiento fue utilizado en relación con casi todas las actividades, pero los viajes fueron más frecuentemente utilizados cuando visitaban rápidamente los árboles frutales o cuando hubo alguna invasión territorial por algún otro grupo de Saguinus. Cuando esto ocurría, los individuos de S. mystax y S. fuscicollis viajaban grandes distancias (a veces 100 m consecutivos) para echar a los invasores, pues se conoce que Saguinus spp. son altamente territoriales (Neyman 1977, Dawson 1977, citados por Terborgh 1983). Otras actividades que S. mystax y S. fuscicollis realizaban esporádicamente fueron el despioje social, con la participación de uno o más individuos y el juego entre las crías y juveniles. Estas dos últimas actividades ocurrían en los momentos de descanso.
Composición de la dieta
La dieta alimenticia de S. mystax y S. fuscicollis se compone principalmente de frutos, insectos y exudado. Se ha observado también que se alimentan de larvas de insectos, arácnidos y pequeños vertebrados (anfibios y saurios). Durante los 6 meses de observación, el porcentaje de tiempo que Saguinus mystax empleó en la obtención y consumo de los principales alimentos fueron: consumo de frutos 90,3%, consumo de exudado 0,2%, búsqueda y consumo de insectos 6,8%, caza y consumo de larvas y arácnidos 1,2% y consumo de pequeños vertebrados 1,3%. El tiempo empleado por S. fuscicollis fue: consumo de frutos 84,7%, consumo de exudado 2,3%, búsqueda y consumo de insectos 10,6%, caza y consumo de larvas y arácnidos 0,5% y consumo de pequeños vertebrados 1,6%, (Cuadro 2). Los frutos y los insectos parecen ser los recursos alimenticios más importantes para ambas especies.
La proporción de consumo de los principales tipos de alimento mostró fluctuaciones estacionales. Ambas especies dedicaron al consumo de frutos el mayor porcentaje de tiempo entre los meses de Febrero y Mayo, coincidiendo esto con la temporada anual de lluvias. Se observó una notable disminución en el consumo de frutos en la temporada seca del año, por la poca disponibilidad de frutos. El porcentaje de tiempo que Saguinus mystax y S. fuscicollis dedicaron a los insectos y exudado no tuvo fluctuaciones relevantes, pero se observó que al disminuir la disponibilidad de frutos hubo incremento en el porcentaje de consumo de dichos recursos.
En cuanto al consumo de insectos, ambas especies de Saguinus mostraron una preferencia por los grillos (Orthoptera). Esta actividad ha sido reportada anteriormente por otros autores. Por ejemplo, en Saguinus imperator y S. fuscicollis (Terborgh 1983), en S. fuscicollis (Izawa 1975; Soini, este volumen), en S. mystax y S. fuscicollis (Garber 1986) y en S. mystax (Gazzo, este volumen).
Consumo de frutos
Uno de los recursos alimenticios más importantes en la dieta de S. mystax y S. fuscicollis fueron los frutos. Durante la estación lluviosa, los frutos fueron más abundantes que en la estación seca, sin llegar a una visible escasez, porque aun en esta época del año estos pequeños primates siempre tuvieron frutos maduros para su consumo. S. mystax utilizó en la dieta principalmente frutos del género Inga sp. (33,3%) y frutos de la familia Sapotaceae (24,9%), (Cuadro 3). S. fuscicollis exhibe un patrón similar; los frutos del género Inga (31,0%) y de la familia Sapotaceae (21,2%), (Cuadro 4).
Cuadro 2.- Porcentaje de tiempo invertido
en obtención y consumo de diferentes tipos de alimento por S. mystax
y S. fuscicollis durante el período de 6 meses de observación
(Feb. a jul., 1985).
|
S. Mystax |
S. fuscicollis |
||
|
Observaciones |
% |
Observaciones |
% |
|
|
1165 | 90,3 | 1159 | 84,7 |
|
3 | 0,2 | 32 | 2,3 |
|
1168 | 90,5 | 1191 | 87,0 |
|
88 | 6,8 | 146 | 10,6 |
|
16 | 1,2 | 7 | 0,5 |
|
18 |
1,3 |
23 |
1,6 |
|
122 |
9,3 |
176 |
12,7 |
|
1290 |
99,8 |
1367 |
99,7 |
Ambas especies de Saguinus de preferencia consumieron frutos maduros. La parte consumida fue el arilo que poseen algunos frutos, como por ejemplo los de la familias Hippocrateaceae, Sapindaceae y Burseraceae. Entre los frutos carnosos más frecuentemente consumidos se encuentran los de la familia Sapotaceae, cuya parte consumida fue el mesocarpio, mientras que el exocar pio era desechado. Las semillas de los frutos eran desechadas y algunas veces ingeridas. La ingestión de éstas dependía probablemente del tamaño de la semilla y naturaleza de la pulpa.
Cuadro 3.- Lista de especies de árboles
utilizados por Saguinus mystax como fuente de frutos
|
Tiempo de consumo | Porcentaje del tiempo |
|
(minutos) |
total de consumo |
|
|
30 | 2,1 |
|
60 | 4,3 |
|
3 | 0,2 |
|
33 | 2,4 |
|
10 | 0,7 |
|
21 | 1,5 |
|
13 | 0,9 |
|
4 | 0,2 |
|
3 | 0,2 |
|
5 | 0,3 |
|
11 | 0,8 |
|
4 | 0,2 |
|
49 | 3.5 |
|
2 | 0,1 |
|
457 | 33,3 |
|
3 | 0,2 |
|
2 | 0,1 |
|
48 | 3,5 |
|
44 | 3,2 |
|
41 | 2,9 |
|
3 | 0,2 |
|
15 | 1,0 |
|
34 | 2,4 |
|
80 | 5,8 |
|
342 | 24,9 |
|
39 | 2,8 |
|
15 | 1,0 |
|
|
1371 | 100 |
Las especies de plantas más importantes que producen frutos consumidos, pertenecen a las familias Sapotaceae, Moraceae y Leguminosae (principalmente el género Inga). Las familias Hippocrateaceae, Menispermaceae y Sapindaceae son consideradas también de importancia, porque producen frutos durante largo tiempo. La dicta incluye también frutos de plantas de las familias Annonaceae, Apocynaceae, Burseraceae, Malpighiaceae, Nyctaginaceae, PaImae, Simaroubaceae y Violaceae, consumidos en pequeñas cantidades (Cuadro 5).
Cuadro 4.- lista de especies de árboles
utilizados por S. fuscicollis como fuente de frutos
|
Tiempo de consumo | Porcentaje del tiempo |
|
(minutos) |
total de consumo |
|
|
24 | 1,6 |
|
53 | 3,5 |
|
8 | 0,5 |
|
20 | 1,3 |
|
24 | 1,6 |
|
2 | 0,1 |
|
11 | 0,7 |
|
3 | 0,2 |
|
109 | 7,2 |
|
464 | 31,0 |
|
6 | 0,4 |
|
20 | 1,3 |
|
34 | 2,2 |
|
54 | 3,6 |
|
88 | 5,8 |
|
37 | 2,4 |
|
16 | 1,0 |
|
20 | 1,3 |
|
7 | 0,4 |
|
4 | 0,2 |
|
69 | 4,6 |
|
26 | 1,7 |
|
317 | 21,2 |
|
5 | 0,3 |
|
65 | 4,3 |
|
9 | 0,6 |
|
|
1495 | 100 |
Cuadro 5.- Características de especies
vegetales consumidas por S. rnystax y S. fuscícollis en Quebrada
Blanco (Río Tahuayo).
|
Familia y especie |
Forma de vida |
Parte consumida |
No. de frutos analizados |
No de semillas en cada fruto |
Dimensiones X del fruto (cm) |
Pesodel fruto X en (g) |
Color |
Período usado |
Consumido por |
||
| 1.Anacardiaceae | |||||||||||
| Tapirira sp.1 | A. | Fr. | 3 | 1 | 1,4 x 1,0 | 1,1 | Marrón oscuro | Feb. Mar. | Sm. | y | Sf. |
| Tapirira sp.2 | A. | Fr. | 8 | 1 | 1,2 x 1,2 | U | Marron oscuro | Mar. Abr. | Sm. | y | Sf. |
| Tapirira sp.3 | A. | Fr. | 3 | 1 | 1,7 x 1,5 | 2,5 | Marrón oscuro | Abril | Sf. | ||
| 2. Armonaceae | A. | Fr. | 3 | 1 | 3,0 x 2,3 | 11,2 | Púrpura | Mayo | Sm. | y | Sf. |
| Annona sp. | A. | Fr. | 1 | 34 | 6,5 x 6,3 | 112,7 | Amarillo claro | Febrero | Sf. | ||
|
3.Apocynaceae |
|||||||||||
| Lacmellea sp. | A. | Fr. | 6 | 1 | 1,2 x 1,1 | 0,9 | Amarillo | May. Jul. | Sm. | y | Sf. |
|
4.Araceae |
|||||||||||
| Heteropsis sp. | L | Fr. | 5 | 1 | 1,1 x 1,5 | 1,5 | Amarfilo | Jun-84 | Sm. | y | Sf. |
| Especie 1 | L. | Fr. | 2 | 1 | 2,3 x 1,4 | 3,4 | Amarfilo | Marzo | Sm. | ||
| Especie 2 | L. | Fr. | 3 | 1 | 1,4 x 0,8 | Amarillo | Feb. | Sm. | y | Sf. | |
| 5.Burseraceae | |||||||||||
|
Especie 1 |
A. |
Fr. |
8 |
1 |
2,8 x 1,9 |
5,2 |
Púrpura |
Febrero |
Sm. |
y |
Sf. |
|
Especie 2 |
A. |
Fr. |
8 |
1-2 |
1,9 x 1,9 |
2,6 |
Púrpura |
julio |
Sm. |
y |
Sf. |
| Protium sp. | A. | Fr. | 1 | 2 | 2,7 x 3,5 | 13,1 | Púrpura | julio | Sm. | y | Sf. |
| 6.Borajinaceae | |||||||||||
| Cordia nodosa | A. | Fr. | 8 | 1 | 1,2 x 1,4 | 1,6 | Amarillo claro | Abril | sm. | ||
| 7. Combretaceae | |||||||||||
|
Buchenavia sp. |
A. | Fr. | 3 | 1 | 1,7 x 1,0 | 1,1 | Amarillo | Abril. May. | Sm. | y | Sf. |
| 8. Clusiaceae | |||||||||||
| Rheedia sp. | A. | Fr. | 8 | 1-4 | 4,4 x 2,7 | 8,6 | Amarillo | unio | Sf. | ||
| 9. Convolvulaceae? | L. | Fr. | 9 | 1 | 1,5 x 1,3 | 1,2 | Marrón | unio | Sm. | y | Sf. |
| 10.Hippocrateaceae | |||||||||||
| Salacia sp. 1 | L. | Fr. | 20 | 1-5 | 3,3 x 2,5 | 10,7 | Amarillo oscuro | Feb.jun. Sm. y Sf | Sf. | ||
| Salacia sp.2 | 1-r. | 9 | 1-3 | 2,8 x 1,9 | 5,2 | Amarillo oscuro | Febrero | ||||
| Salacia sp.3 | L. | Fr. | 4 | 3-10 | 4,0 x 3,9 | 28,8 | Amarillo oscuro | Abr. jun. jul Srn. | Sm. | y | Sí. |
| Salacia sp.4 | L. | Fr. | 3 | 5-19 | 4,5 x 3,6 | 32,1 | Amarillo oscuro | Mayo Feb. May. | |||
|
11.Leguminosae |
Sm. |
y |
Sf. |
||||||||
| Inga sp.1 | A. | Fr. | 22 | 04-10 | 3,4 x 2,1 | 17,7 | Verde | junio | |||
| Inga sp.2 | A. | Fr. | 29 | 6-13 | 13,8 x 1,3 | 6,9 | Verde | Mar. Abr. | Sm. | y Sf. | |
| Inga sp.3 | A. | Fr. | 7 | 03-7 | 7,0 x 2,1 | 7,6 | Verde | Feb. Mar. | Sm. | ||
| Inga sp.4 | A. | Fr. | 2 | 18-20 | 23,3 x 1,8 | 19,6 | Verde | Nov. | Sm. | ||
| Inga sp.5 | A. | Fr. | 1 | *19,0 x 3,1 | 14,8 | Verde | Mar. | Sm. | y Sf. | ||
| Parkia sp. | A. | Ex. | jun. jul. | SM, | y Sf. | ||||||
| Parkia opposítifoMI , | A. | Fr. | 5 | 16-20 | 23,8 x 4,0 | 23,8 | Marrón oscuro | jun. | Sm. | y Sf. | |
| 12.Linaceae | |||||||||||
| Raucheria sp.1 | A. | Fr. | 10 | 1 | 1,1 x 0,9 | 0,6 | Marrón | Mayo | Srn. | y | Sf. |
| Rauchería SPI | A. | Fr. | 6 | 1 | 1,2 x 1,1 | 1,0 | Marrón | jun. | Sm. | y | Sí. |
| 13.Moraceae | |||||||||||
| Helycostilis sp. | A. | Fr. | 23 | 02-10 | 1,1 x 1,4 | 1,3 | Amarillo | Feb. Mar. May. Jun.julio | Sm. | y | Sf. |
| Pourouma sp.1 | A. | Fr. | 16 | 1 | 1,3 x 0,9 | 0,4 | Guinda oscuro | Febrero | Sm. | ||
| Pourouma sp.2 | A. | Fr. | 18 | 1 | 1,3 x 1,2 | 1,2 | Cuinda oscuro | Feb. jul. | Sf. | ||
| Pourouma sp.3 | A. | Fr. | 19 | 1 | 1,4 x 1,1 | 1,0 | Cuinda oscuro | Die. Feb. | Sm. | y | Sf. |
| Pourouma sp.4 | A. | Fr. | 3 | 1 | 2,3 x 1,6 | 1,7 | Amarülo verdoso | Marzo | Sm. | ||
| NaucleopsiS sp. | A. | Fr. | 1 | 1 | 5,4 x 5,3 | Amarillo | Mayo | Sm. | |||
| Ficus sp. | L. | Fr. | 8 | 100 | 0,7 x 0,7 | 0,2 | Rojo | Febrero | Sm. | y | Sf. |
| 14.Myrtaceac | |||||||||||
| Especiel | A. | Fr. | 12 | 1-2 | 1,1 x 1,1 | 1,0 | Guinda claro | Feb. Abr. | Sf. | ||
| Especie2 | A. | Fr. | 8 | 1 | 1,2 x 1,2 | 1,2 | Guinda oscuro | Abril | Sm. | y | Sf. |
| Especie3 | A. | Fr. | 10 | 1 | 1,1 x 1,0 | 0,7 | Guinda | jun. | Sm. | y | Sf. |
| Especíe4 | A. | Fr. | 8 | 1 | 0,9 x 1,0 | 0,7 | Caoba | julio | Sm. | y | Sí. |
|
15.Menispermamo |
|||||||||||
| Abuta. s | L. | Fr. | 24 | 1 | 2,5 x 1,5 | 2,5 | Verde | Feb. jun. jul. | Sm. | y | Sf. |
| Especie 1 | Fr. | 3 | 1 | 1,9 x 1,1 | 1,0 | Verde amarillo | Marzo | Sm. | y | St. | |
| 16.Malpioiaceae | |||||||||||
| Byrsoníma sp. | A. | Fr. | 4 | 1 | 1,2 x 1,4 | 1,4 | Verde oscuro | Abr. May. | Sm. | y | |
| Especie | A. | Fr. | 9 | 1 | 1,0 x 1,0 | 0,4 | Verde claro amarillo | May. Jul. | Sm. | y | |
| 17.Nyctaginaceae | |||||||||||
| Especiel | A. | Fr. | 21 | 1 | 2,1 x 1,5 | 3,2 | Púrpura | Abr. jun. Sm. y | SL | ||
| Especie2 | A. | Fr. | 3 | 1 | 1,5 x 1,2 | 1,9 | Púrpura | May. Jun. | Sm. | y | Sf. |
| 18.Palmae | |||||||||||
| Wettinia sp. | A. | Fr. | 2,5 x 1,7 | 3,8 | Amarillo | Febrero | Sin. | y | SL | ||
| 19.Rubiaceae | |||||||||||
| Duroia sp. | A. | Fr. | 4 | 19-120 | 3,8 x 2,3 | 9,2 | Verde el | jun. jul. | Sm. | ||
| Pagamea sp. | A. | Fr. | 5 | 1,2 | 1,4 x 1,1 | 1,5 | Negro | junio | Sm. | y | SI |
| 20.Sterculiaceae | |||||||||||
| Theobroma sp. | A. | Fr. | 1 | *3,8 x 3,8 | 30,0 | Verde | julio | Sf. | |||
| 21.Sapotaceae | |||||||||||
| Ecclinusa sp. | A. | Fr. | 10 | 2 | 2,5 x 2,4 | 4,7 | Amarillo oscuro | Feb. Marzo | Sm. | y | S |
| Chrysophyllum sp. | A. | Fr. | 8 | 01-Feb | 4,1 x 3,6 | 23,3 | Amarillo | julio | Sm. | y | S |
| Poulerma sp.1 | A. | Fr. | 5 | 03-4 | 3,3 x 3,0 | 14,2 | Arnarfilo ocre | Mayo | Sm. | ||
| Pouteria sp.2 | A. | Fr. | 19 | 1 | 2,2 x 1,7 | 3,1 | Guinda oscuro | junmo | Sm. | ||
| No identif.l | A. | Fr. | 12 | 1 | 1,6 x 1,2 | 1,4 | Guinda | mayo | Sm. | y | Sf. |
| No identif.2 | A. | Fr. | 5 | 1 | 3,7 x 2,8 | 17,4 | Marrón | junio | Sm. | y | St |
| No identif.3 | A. | Fr. | 8 | 1 | 1,3 x 1,0 | 0,6 | Guinda oscuro | junio | Sf. | ||
| No identif.4 | A. | Fr. | 10 | 1 | 1,9 x 1,8 | 3,3 | Amarillo | julio | Sm. | y | S |
| No identif.5 | A. | Fr. | 3 | 1-2 | 2,6 x 2,1 | 6,4 | Amarillo | May. jun. | Sm. | y | S |
| No identif.6 | A. | Fr. | 10 | 1 | 2,3 x 2,0 | 4,5 | Marrón | Feb. Mar. Sm. y | SI., | ||
| No identif.7 | A. | Fr. | 5 | 1 | 2,0 x 1,5 | 2,6 | Caoba marTén | Mayo | Sm. | S | |
| 22.Sapindaceae | |||||||||||
| Paullinia sp.1 | L. | Fr. | 24 | 1 | 1,7 x 2,3 | 3,0 | Amarillo oscuro | Feb. Abr, jun. jul. | Sm, | y | S |
| Paullinia sp.2 | L. | Fr. | 6 | 1 | 2,0 x 2,8 | 7,2 | Amarillo oscuro | julio | Sm. | ||
| 23.Simaroubaceae | |||||||||||
| Simarauba amara | A. | Fr. | 11 | 1 | 1,6 x 1,2 | 1,5 | Verde | Febrero | Sm. | y | SL4 |
| 24.Violaceae | |||||||||||
| Leonia gIycycarpa | A. | Fr. | 4 | 8-14 | 4,0 x 4,0 | 33,3 | Marrón cenizo | Dic. | Sm. | y | Sf |
| Leon la cymosa | A. | Fr. | 3 | 2-3 | 2,0 x 1,8 | 3,9 | Amarillo | junio | Sm. | y | Sf |
| Arbol # 117 | A. | Ex. | 2-7 | ||||||||
| A. = Arbol | Fr. = Fruto | Sm. = Saguinus mystax |
| L = Liana | Ex. = Exudado | Sf . = Sanguinus fuscicollis |
| * = Solamente se trabajó con una muestra de fruto |
Sgún Gazzo (este volumen) reporta que las plantas de la familia Leguminosae y Moraceae fueron las que contribuyeron en mayor cantidad a la dicta de S. mystax en Padre Isla. Terborgh (1983) reporta que las plantas más importantes en producir frutos para los primates en el Parque Nacional Manu fueron de las familias Moraceae, Annonaceae, Palmae y Leguminosae.
Consumo de exudado
S. fuscicollis dedicó el 2,3% de su tiempo al consumo de exudado y S. mystax el 0,2%. El exudado juega un rol relativamente insignificante en la dicta de S. mystax, pero en S. fuscicollis parece ser más significativo. Durante el consumo de exudados, con frecuencia observamos que individuos de S. fuscicollis lamían la goma que escurría de la corteza de los árboles, mientras que los individuos de S. mystax se mantenían a una distancia relativamente cerca. S. fuscicollis utilizó como fuente principal de exudado a plantas del género Parkia.
Tamaño y peso de los frutos
S. mystax y S. fuscicollis tienden a comer frutos de toda clase y tamaño. Por ejemplo, se observó que ambas especies de Saguinus comen frutos tan grandes como Leonia glycycarpa (Diciembre), Chrysophy11um sp. (julio) y frutos de la familia Hippocrateaceae. En contraste, también comen frutos tan pequeños como Ficus sp. (Febrero), cuyo tamaño es de 5-7 mm. Normalmente, los frutos grandes son manipulados y consumidos a mordiscos en el mismo lugar de origen sin ser desprendidos de las ramas. Los frutos grandes registraron pesos elevados, como ocurre con Leonia glycycarpa, cuyo peso promedio es de 33,3 g. Los frutos pequeños, como Ficus sp.; registraron un peso promedio de 0,1-0,2 g. Terborgh (1983) reporta que Saguinus fuscicollis en Parque Nacional Manu comieron frutos tan grandes como Leonia glycycarpa y frutos tan pequeños como Ficus sp. (menores de 5 mm). Soini (este volumen) afirma que S. fuscicollis en el Río Pacaya comieron frutos de tamaño pequeño (diámetro menor de 2 cm), frutos de tamaño medio (24 cm) y frutos de tamaño grande, como las vainas de la familia Leguminosae.
Dureza y color de los frutos
La mayoría de los frutos consumidos fueron blandos y fugaces. Algunos frutos, como Helycostilis sp. son extremadamente fugaces, que al movimiento por los animales, caen al suelo en apreciables cantidades. Otros frutos presentan una cubierta cuyo espesor es de 1-3 mm, aunque igualmente blandas, como los frutos de Abuta sp.; Byrsonima sp., Lacmellea sp., Protium sp., Raucheria sp. y Rheedia sp. Otros frutos son blandos pero presentan una cáscara gruesa, como por ejemplo los frutos de Annona sp., Leonia glycycarpa y Salacia sp., cuyo grosor de cáscara fluctúa entre 4,0 y 9,0 mm. Entre los frutos considerados duros están las vainas de las numerosas especies de Inga (grosor de 1,0 - 2,0 mm).
Entre los frutos consumidos predomina el color amarillo, verde, marrón y púrpura. Solamente se ha registrado una especie de fruto de color negro (Pagamea sp.) y algunos frutos de color rojo Ficus sp. (Moraceae) y Sapotaceae (Cuadro 6).
Fenología de los frutos
La composición de la dieta del grupo de estudio dependió de la disponibilidad de frutos. Con el fin de conocer mejor este último factor, se realizaron observaciones de la fenología (fructificación) de un grupo de especies vegetales utilizadas como alimento desde junio 1984 a julio 1985.
De las 11 primeras especies observadas, el 75% de los árboles de cada especie produjeron frutos en el período de un mes; en las 13 especies subsiguientes por lo menos el 50% produjo frutos en el período de un mes, y en 3 de los casos restantes por lo menos el 40% de especies fructificaron en el período de un mes. Muchas de las especies incluidas en el muestreo fonológico fructificaron más que una vez en un año. Por ejemplo, Parkia velutina fructificó en junio 1984 y nuevamente estuvo con fruto en Febrero-Abril 1985. Otras especies vegetales, como Inga sp., Pagamea sp., Raucheria sp. y Leonia cymosa fructificaron en junio 1984 y en Abril 1985 (Cuadro 7).
Dispersión de semillas
S. mystax y S. fuscicollis fueron observados ingerir y evacuar intactas las semillas de los diferentes frutos. Como se puede apreciar en el Cuadro 8, S. mystax contribuyó a la dispersión principalmente de Helycostilis sp. (23,1%), Inga sp. (19,4%), Nyctaginaceae (17,5%), Salacia sp. (12%) y Abuta sp. (10,1%). S. fuscicollis contribuyó a la dispersión de Inga sp. (39,1%), Helycostilis sp. (19,5%), Sapotaceae (15,2%) y Nyctaginaceae (9,7%). los porcentajes de dispersión más elevados están reportados por aquellos frutos que presentan una pulpa fibrosa.
Cuadro 6.- Color de los frutos consumidos por S. mystax y S. fuscicollis en Quebrada Blanco (Río Tahuayo)
|
Negro | Púrpura | Verde | Amarillo | Rojo | Marrón | Blanco |
|
1 | 5 | 8 | 19 | 2 | 6 | 0 |
|
Ve
rde oscuro |
Amarillo verdoso |
Amarillo |
Rojo |
Marrón |
||
|
|
Verde Amarillento 3 |
Amarillo Naranja 1 |
|||||
Cuadro 7.- Patrones de fructificación
de especies de plantas consumidas por S. mystax y S. fuscicollis durante
1984 y 1985.
|
N* de árboles |
% de árboles fructificando en el período de un rnes |
Período de Fructificación 1984 - 1985 |
|||
|
1984 |
1985 |
Promedio |
1984 | 1985 | ||
|
2 | 100% | Marzo | |||
|
2 | 100% | Febrero | |||
|
2 | 100% | julio | |||
|
2 | 100% | Mayo-junio | |||
|
3 | 100% | junio-julio | |||
|
2 | 100% | Mayo | |||
|
3 | 100% | Mayo-junio | |||
|
2 | 100% | 100% | 100% | junio | Abril-Mayo-Junio |
|
11 | 82% | Mayo-junio | |||
|
4 | 75% | Febrero | |||
|
4 | 75% | Mayo | |||
|
3 | 100% | 66,6% | 83,3% | junio | Abril- ? |
|
3 | 66,6% | Marzo | |||
|
3 | 66,6% | Junio-Julio | |||
|
3 | 66,6% | Mayo | |||
|
3 | 57% | Marzo | |||
|
7 | 57% | julio | |||
|
2 | 100% | 50% | 75% | junio | Abril-? |
|
6 | 100% | 50% | 75% | junio-julio | Abril-Junio-julio |
|
4 | 50% | Febrero-Marzo | |||
|
8 | 50% | Junio-Julio | |||
|
4 | 50% | Marzo | |||
|
2 | 50% | Abril-junio | |||
|
2 | 50% | Marzo-Mayo | |||
|
17 | 47% | Mayo-junio | |||
|
11 | 45% | Junio-Julio | |||
|
10 | 100% | 40% | 70% | junio | Mayo |
|
30 | 36,6% | julio | |||
|
³ | 100% | 33% | 66,5% | junio | Febrero-Abril |
* Grupo de 6 especies de plantas, fueron observadas su Fonología, desde Junio 1984 hasta junio 1985. Aquellas con signo de interrogaci6la, continuaron fructificando aún después de interrogación, continuaron fructificando aún después de
Cuadro 8
|
No. de semíllas presentes en las heces de S. mystax | Porcentaje |
|
11 | 10,1% |
|
1 | 0,9% |
|
4 | 37,911 |
|
25 | 23,1% |
|
21 | 19,4% |
|
1 | 0,9% |
|
19 | 17,5% |
|
1 | 0,9% |
|
4 | 3,7% |
|
13 | 12,0% |
|
3 | 2,7% |
|
5 | 4,6% |
| 100% | 108% |
|
No. de semillas presentes en las heces de S. fuscicollis | Porcentaje |
|
2 | 2,1% |
|
2 | 21,0% |
|
18 | 19,5% |
|
36 | 39,1% |
|
9 | 9,7% |
|
1 | 1,0% |
|
1 | 1,07. |
|
5 | 5,4% |
|
3 | 3,2% |
|
14 | 15,2% |
|
1 | 1,0% |
|
|
92 | 100% |
Uso del espacio vertical en las actividades alimenticias
El consumo de frutos se realizó en el estrato medio del bosque, altura promedio 16 m y 14 m, respectivamente. Durante la búsqueda de insectos, ambas especies mostraron una marcada preferencia por el estrato bajo, registrándose un promedio de 9 m en S. mystax y 5,5 m en S. fuscicollis (Cuadro 9). El uso del estrato bajo por ambas especies probablemente se debió a que en este estrato del bosque encontraban mayor abundancia de insectos. Algunas veces, S. fuscicollis fue observado utilizar el suelo por breves segundos para la búsqueda.
Cuadro 9.- Distribución vertical de
las principales actividades del grupo mixto de estudio de S. mystax y S.
fuscícollis.
| Promedio de altura (m) | ||
|
S. mystax |
S. fuscicollis | |
|
16,3 | 14,0 |
|
9,0 | 5,5 |
|
10,6 | 6,5 |
|
13,2 | 8,7 |
|
10,4 | 7,3 |
|
11,57 | 8,58 |
DISCUSIÓN
El tipo de hábitat parece tener influencia en la variación de la alimentación de ambas especies. La alimentación de S. fuscicollis en el Río Pacaya fue altamente insectívora, porque el mayor porcentaje de tiempo fue dedicado a la caza de insectos y un menor porcentaje al consumo de frutos, exudados y néctar (Soini, este volumen). En comparación, S. fuscicollis de la Quebrada Blanco (hábitat de altura) se alimentaba de frutos. Los porcentajes de tiempo de preferencia dedicado a la obtención de diferentes tipos de alimentos fueron consumo de frutos 84,7%, consumo de exudados 2,3% y caza de insectos y pequeñas presas 12,7%.
S. mystax en Padre Isla, Iquitos (hábitat de várzea estacional) son moderadamente frugívoros; el 43,7% del tiempo de alimentación fue dedicado al consumo de frutos, el 19,6% al consumo de exudado y el 32,6% a la caza de insectos (Gazzo, este volumen). En comparación, S. mystax en Quebrada Blanco (hábitat de altura) mostró ser marcadamente frugívoro. El tiempo dedicado a la alimentación estuvo distribuido de la siguiente manera: consumo de frutos 90,3%, consumo de exudados 0,2%, y caza de insectos y pequeñas presas 9,3%.
S. fuscicollis en Parque Nacional Manu (hábitat de altura y algunas zonas inundables) mostró hábitos frugívoros e insectívoros en igual proporción, consumo de vegetales 50% y caza de insectos 50% (Terborgh 1983). En comparación, S. fuscicollis en nuestra área de estudio (hábitat de altura) mostró ser más frugívoro que insectívoro, dedicando el 87% del tiempo al consumo de frutos.
RESUMEN
Aspectos relacionados con la dicta de 2 especies de primates, fueron estudiados durante un período de 6 meses en la Quebrada Blanco, Ría Tahuayo (Dpto. de Loreto, Perú). Saguinus mystax y S. fuscicollis dedican entre(s 40 y 50% de su tiempo al descanso. Las demás actividades, como alimentación desplazamiento y viajes alcanzaron porcentajes menores de 22%. La composición, de la dieta de ambas especies en esta área consiste mayormente en frutos (más del 80% del tiempo de alimentación) y en menor proporción están 1(1~ insectos. Las especies de plantas más importantes que producen frutos pertenecen a las familias Sapotaceae, Moraceae y Leguminosae. Consumen frutos de diferentes tipos y tamaños, siendo la mayoría de ellos blandos al 1Mc Las especies de árboles tomadas como muestra fenológica fructificaron más que una vez al año. Los frutos que presentaron los mayores porcentajes de dispersión por los Saguinus fueron aquellos que tenían pulpa fibrosa. Durante las actividades alimenticias, utilizaron principalmente los estratos medio y bajo del bosque.
REFERENCIAS
Bauchop, T. 1978. Digestion of leaves in vertebrate arboreal folivores. pp. W19MIL En G. Montgomery (Ed.). The ecology of arboreal folivores. Smithsonian Inst.Press, Washington, D.C.
Dunbar, R.I. y E.P. Dunbar. 1979. Ecological relations and niche separation between sympatric terrestrial primates in Ethiopia. pp. 187-209. En R.W. Susman (Ed.). Primate Ecology: Problem-Oriented Field Studies. New York.
Garber, P. A. 1986. The ecology of seed dispersal in two species of Callitrichid-, primates (Saguinus mystax and S. fuscicollis). Am. 1. Primatol. 10:155-170.
Gazzo, C. (este volumen). Estudios bioecológicos de tres grupos del pij1lir« barba blanca (Saguínus mystax Spix 1823) en Padre Isla (Iquitos). Tesis Biólogo. Universidad Nacional Agraria La Molina, Lima. 148 pp.
Izawa, K. 1975. Foods and feeding behavior of monkeys in the upper Amazon, basin. Primates 16(3): 295-316.
Klein, L. y D.J. Klein. 1979. Social ecological contrasts between four taxas of Neotropical primates. pp. 107-131. En R.W. Sussman (Ed.) Primate Ecology: Problem -Oriented Field Studies. New York.
Post, D.C. 1981. Feeding behavior of yellow baboons (Papio cynocephalus in the Ambosoli National Park, Kenya. Int. 1. Primatol. 3(4):403430.
Richard, A. 1979. Intra-specific variation in the social organization and ecology of Propithecus verreauxi. Pp. 23-51. En R.W. Sussman (Ed.). Primate Ecology: Problem -Oriented Field Studies. New York .
Soini, P. (este volumen). Ecología y dinámica poblacional del pichico común Saguinus fuscicollis (Primates, Callitrichidae).
Sussman, R.W. 1979. Ecological distinction in sympatric species of Lemur. pp. 53-84. En R.W. Sussman (Ed.). Primate Ecology: Problem-Oriented Field Studies. New York.
Terborgh, J. 1983. Five New World Primates.
A study in comparative ecology. JAR. Krebs and Clutton-Brock (Eds.). Princeton
University Press. 251 pp.

