

5.1. AMBIENTE FISICO
5.1.1.-DESCRIPCION DE LA CUENCA E HIDROLOGIA
El área de estudio se localiza en selva alta y comprende un sector del río Huallaga Central, entre la desembocadura del río Huayabamba y Chazuta. Las nacientes de las principales sub cuencas (ríos Huayabamba y Mayo) que fluyen al río Huallaga, se originan en los Andes a 4,000 msnm; sin embargo, los valles formados en las partes media y baja de los principales ríos en estudio, presentan altitudes que no sobrepasan los 1,000 msnm. Estos ríos recorren terrenos colinosos formando valles aluviales intramontanos.
Los valles, en sus partes media y baja, presentan una pendiente longitudinal baja, generalmente, por debajo del 0.5 % (Tabla 5.1), sugiriendo que los ríos discurren por cauces relativamente planos. Las áreas de inundación de estos cuerpos de agua son inexistentes o muy pequeñas, si los comparamos con aquellos ríos del llano amazónico y del Africa. El río Kafue, uno de los ríos africanos, de donde son oriundas las especies de "tilapia", tiene una pendiente suave (0.38 a 0.09 %); y presenta grandes áreas de inundación (FAO, 1968, citado en Chapman et al, 1971). Estas condiciones hidrológicas se presentan también en los ríos de Amazonía baja, que tienen pendientes de menos del 0.1% y grandes áreas de inundación; de esta zona proceden peces como paiche, tucunaré, acarahuazú, entre otros, que también, deben ser considerados como introducciones a la cuenca.
Por otro lado, es notoria la presencia de "rápidos" y "malpasos" en ciertos sectores de los ríos los que se caracterizan por presentar fuertes desniveles de su cauce en tramos muy cortos, obstruidos parcialmente por rocas y piedras, formando gran turbulencia que dificulta la dispersión y distribución de las especies acuáticas no adaptadas a estas condiciones. Puede citarse a los rápidos de "Marona", ubicado en el río Mayo, aguas abajo de Moyobamba; los malpasos de "Estero", "Shumía" y "Vaquero", en el río Huallaga, entre la desembocadura del Mayo y la localidad de Chazuta.
Tabla 5.1. Porcentaje de pendiente en los valles del área de estudio.
|
Lugares |
Pendiente (%) |
|
Moyobamba-Desembocadura del río Mayo |
0.41 |
|
Saposoa-Desembocadura del río Saposoa |
0.28 |
|
San José de Sisa-San Pablo |
0.31 |
|
San Pablo-Desembocadura del río Sisa |
0.16 |
|
Boca del Huallabamba-Boca del Mishquiyacu |
0.11 |
|
Desembocadura del río Mishquiyacu-Chazuta |
0.008 |
|
Chazuta-Desembocadura del río Caynarachi |
0.008 |
|
Desembocadura del río Caynarachi-Yurimaguas |
0.02 |
Se ha tomado la clasificación de Berg citado por Arrignon (1979) con la finalidad de clasificar a los ríos por la velocidad de corriente. Asimismo, las condiciones hidrológicas del área de estudio que se van a describir a continuación, son semejantes a las de ríos que existen en Amazonía baja o Llano Amazónico.
En el área de estudio, el río Huallaga tiene un recorrido SO-NE y es característica saltante la escasez de ambientes lénticos importantes. Destaca el Lago Sauce, cuya extensión es de 450 ha de espejo de agua (Fukushima et al., 1971). El Huallaga presenta un ancho promedio de 302 m, con velocidad de corriente muy rápida a rápida (1.52 m/s, en creciente y de 1.93 a 0.97 m/s, en vaciante (Tabla 5.2). Sin embargo, en los denominados "malpasos" la velocidad de corriente es mucho mayor, tal como ocurre en el lugar denominado "malpaso de Shumía". La configuración del cauce del río Huallaga es de material, predominantemente pedregosa; sin embargo, existen áreas donde las riberas son de material mas suave (arena) y fácilmente erosionables (Correa et al., 1980).
Al río Huallaga, en el área de estudio, llegan una serie de afluentes que forman sub-cuencas de diversa magnitud y forma. Entre las principales subcuencas de la margen izquierda tenemos a los ríos Huayabamba, Saposoa, Sisa y Shanusi, que se caracterizan por tener una red de drenaje de forma angulado y, la subcuenca del río Mayo, cuya red de drenaje es de forma pinada, siendo todas ellas de textura media. Para determinar el tipo de drenaje de los cuerpos de agua estudiados se basó en la clasificación de Way (1978), citado en Ministerio de Obras Públicas y Transportes. (1991).
Por la margen derecha tenemos a la sub cuenca del río Biavo, que presenta una red de drenaje diversificada; así, en la parte alta es de tipo angular y en la parte baja tiende a ser de forma pinada y de textura media.
Los ríos de estas subcuencas son de cauce estrechos y de material predominantemente rocoso y pedregosos. Igualmente, es característico la escasez de ambientes lénticos importantes en todas ellas. Los ambientes lénticos del sector del Alto Mayo son formados por desvíos en el curso del río o son brazos del mismo.
El río Huayabamba, de 100 m de ancho promedio, es poco profundo (Campos, 1983), su cauce está predominantemente conformado de material pedregoso; sin embargo, parte de sus riberas presenta material arenoso. La velocidad de corriente es muy rápida, 1.52 y 2.28 m/s, en creciente y vaciante, respectivamente (Tabla 5.2). Su recorrido general es de NO-SE.
El río Saposoa, también, es poco profundo, tiene un ancho promedio de 70 m. Presenta velocidad de corriente rápida en creciente (0.74 m/s) y muy rápida en vaciante (1.76 m/s). Su cauce está conformado principalmente de material arenoso y pedregoso, principalmente en su curso inferior. Su recorrido general es de NO-SE, y su desembocadura en el río Huallaga ocurre a la altura del poblado de Tingo de Saposoa.
Otro de los afluentes principales del río Huallaga es el río Sisa, con ancho promedio de 70 m. En creciente, la velocidad de corriente es de nivel medio (0.32 m/s) a la altura del poblado de Agua Blanca; sin embargo, río abajo la velocidad de corriente se torna lenta con tendencia a ser muy lenta (0.12 m/s) (Tabla 5.2). Contrariamente, en el periodo de vaciante, los valores de velocidad de corriente se invierten, es decir, en el sector medio la velocidad de corriente es lenta (0.23 m/s) y en el sector bajo, este parámetro es de nivel medio (0.40 m/s). Este hecho es explicable por la presencia de pequeñas zonas con "rápidos". El río Sisa tiene un recorrido general de NO-SE y su desembocadura en el río Huallaga se realiza a la altura del poblado de Puerto Rico.
Otro afluente importante, en el sector estudiado, es el río Mayo que tiene 80 m de ancho medio (Campos, 1983), siendo somero en los sectores medio y bajo donde es accesible solo con embarcaciones pequeñas. Sin embargo, en el Alto Mayo el río es más profundo, permitiendo la navegación de embarcaciones hasta de 8 t (Correa et al., 1983). En el periodo de creciente, la velocidad de la corriente en el Alto Mayo es de nivel medio (0.41 m/s); por otro lado, cuando baja el nivel de las aguas, la velocidad se torna muy rápida (1.16 m/s; Tabla 5.2), llegando a alcanzar valores de 2.76 m/s en los "rápidos" presentes debajo de la desembocadura del río Gera y, posiblemente, niveles superiores a estos valores en los impresionantes "rápidos de Marona". En el Bajo Mayo (Puente Colombia) la velocidad de corriente es muy rápida (1.14 m/s). El río Mayo tiene un recorrido general NO-SE y su desembocadura se produce en las inmediaciones del poblado de Shapaja.
Los tributarios menores del río Huallaga y de sus principales afluentes presentan velocidad de corriente muy variada. Los mismos se encuentran fuertemente influenciados por las precipitaciones locales del momento, es decir, cuando ocurren pequeñas, moderadas o intensas lluvias, trae como consecuencia la inmediata variación de la velocidad y caudal de estos pequeños afluentes. Tal es el caso de los tributarios del río Mayo; el Indoche, por ejemplo, presenta velocidad de corriente muy rápida en creciente (0.54 m/s) y en vaciante (0.57 m/s); sin embargo, en el río Gera la velocidad de corriente es de nivel medio (0.41 m/s en vaciante). Lo mismo ocurre con los ríos Cumbaza y su afluente la quebrada Ahuashiyacu.
El color del agua de los ambientes acuáticos está relacionado al color visual aparente y al material inorgánico en suspensión; siendo muy variable en muchos de los cuerpos de agua muestreados.
La transparencia de la mayoría de estos cuerpos de agua tiende a disminuir debido al aumento considerable de la carga de material en suspensión después de las lluvias. Esto limita una efectiva productividad primaria.
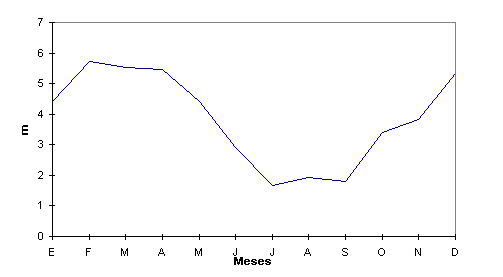
Como se observa en la figura 1, el río Huallaga, a la altura de Yurimaguas, presenta dos periodos hidrológicos bien marcados. El período de creciente, los meses de diciembre enero, febrero, marzo y abril y el periodo de vaciante, los meses de julio, agosto y setiembre. Los periodos de transición ocurren en mayo y junio para la media vaciante y octubre y noviembre para la media creciente. Durante el periodo de creciente, el nivel del agua subió en 8.24 m (02 de febrero, 1996); sin embargo, durante el periodo de vaciante, el menor valor encontrado fue de 1.07 m (21 de julio, 1996). Si entendemos que los niveles de río principal es el resultado de lo que sucede en los tributarios, es obvio, que la periodicidad puede ser la misma, con cierto adelanto, pero, con la irregularidad que tienen los cause pequeños, que se ven influenciados directamente por el régimen de lluvias. Es decir, durante periodos largos de ausencia de lluvias, el nivel de los ríos permanece aparentemente estable; sin embargo, cuando ocurren las lluvias, y dependiendo de su intensidad, el nivel de las aguas se eleva sustancialmente afectando las condiciones hidrológicas de los cursos de agua.
Tabla 5.2. Parámetros hidrológicos de los cuerpos de agua muestreados.
|
Cuerpo de agua |
Transparencia cm |
Velocidad media m/s |
Color |
Fondo |
|||
|
Período |
Creciente |
Vaciante |
Creciente |
Vaciante |
Creciente |
Vaciante |
|
|
1.Río Huallaga 1 |
13 |
83 |
|
1.933 |
Marrón |
Verde |
Areno arcillosa |
|
2.Río Huallaga 2 - |
5 |
30 |
1.52 |
1.284 |
Marrón |
Verde |
Areno arcilloso |
|
3.Río Huallaga 3 |
12 |
20 |
|
0.969 |
Marrón |
Marrón |
Areno arcilloso |
|
4.Caño ajo |
16 |
45 |
|
0.272 |
Marrón |
Marrón |
Limoso |
|
5.Río Saposoa |
35 |
2 |
0.74 |
1.756 |
Marrón |
Marrón |
Pedregoso |
|
6.Qda Sacanche |
20 |
50 |
|
0.771 |
Clara |
Marrón |
Pedregoso |
|
7.Río Sisa Medio |
Total |
20 |
0.32 |
0.232 |
Negra |
Marrón |
Areno-pedregoso |
|
8.Represa S.Pablo |
15 |
13 |
|
|
Verde |
Marrón |
Areno-pedregoso |
|
9.Río Sisa Bajo |
40 |
30 |
0.12 |
0.388 |
Negra |
Marrón |
Areno-pedregoso |
|
10.Tributarios-R. Sisa Bajo |
100 |
89 |
|
0.204 |
Negra |
Negra |
Limoso |
|
11.Qda. Mishquiyacu |
100 |
76 |
0.86 |
0.269 |
Negra |
Clara |
Limoso-pedregos |
|
12.Lago Sauce |
|
205 |
|
|
Clara |
Verde |
Areno-limoso |
|
13.Río Alto Mayo |
11 |
34 |
0.41 |
1.163 |
Marrón |
Marrón |
Pedregoso |
|
14.Río Tónchima |
5 |
52 |
|
0.584 |
Marrón |
Marrón |
Areno-pedregoso |
|
15. Represa Mashuyacu |
12 |
58 |
|
|
Marrón |
Negra |
Areno-pedregoso |
|
16.Río Indoche |
5 |
60 |
0.54 |
0.570 |
Marrón |
Marrón |
Areno-pedregoso |
|
17.Represa del Gera |
45 |
58 |
|
|
Negra |
Negra |
Limoso |
|
18.Río Gera alt boca |
20 |
80 |
|
0.410 |
Negra |
Verde |
Limoso-pedregoso |
|
19. Río Bajo Mayo |
|
20 |
|
1.136 |
|
Marrón |
Arcillo-pedregoso |
|
20.Río Cumbaza-S.Antonio |
Total |
Total |
0.8 |
0.171 |
Clara |
Clara |
Pedregoso |
|
21.Río Cumbaza-J. Guerra |
Total |
Total |
0.34 |
0.317 |
Clara |
Clara |
Pedregosa |
|
22.Qda. Ahuashiyacu |
Total |
Total |
|
0.318 |
Clara |
Clara |
Pedregosa |
|
23.Qda. Pucayacu |
Total |
Total |
|
0.206 |
Clara |
Clara |
Arenoso |
|
24.Río Shanusi |
20 |
|
0.47 |
|
Marrón |
|
Areno-pedregoso |
|
25.Río Yuracyacu |
20 |
|
0.47 |
|
Marrón |
|
Areno-pedregoso |
|
26.Río Huallabamba (boca) |
20 |
Total |
1.52 |
2.275 |
Marrón |
Marrón |
Arenoso |
|
27. Laguna Limón |
|
80 |
|
|
|
Clara |
Arenoso |
Figura 1. Niveles de agua del río Huallaga a la altura de Yurimaguas. 1996.
5.1.2.- FISICA Y QUIMICA DEL AGUA
Los análisis de las características físicas y químicas que se han realizado en el presente trabajo (Tabla 5.3) y los realizados desde 1979 a 1981 (Tablas 5.4 y 5.5, Ministerio de Pesquería-San Martín) y en 1984 (Tabla 5.6, ONERN) en los diferentes cuerpos de agua, nos muestran que, generalmente, presentan niveles que favorecen al desarrollo de organismos hidrobiológicos. En ese sentido, las características físicas y químicas, analizadas en ese espectro temporal, han sufrido pequeñas variaciones.
Los valores de temperatura, pH, oxígeno disuelto, contenido de sólidos disueltos, alcalinidad y dureza son característicos de aguas saludables y de diferentes grados de productividad potencial, la misma que oscila entre cuerpos de agua piscícolas típicas muy productivas (Río Huallaga, Huallabamba, Sisa y Mayo y Lago Sauce) a cuerpos de agua incrustantes muy duras (ríos Saposoa, tributarios menores de los ríos Mayo y Sisa). Por otro lado, la laguna Limón presenta aguas excesivamente duras (1,539 mg/l CaCO3) que podrían estar afectando el bienestar de la fauna ictiológica presente.
Los niveles de salinidad, generalmente, son bajos; sin embargo, existen cuerpos de agua, especialmente los pequeños tributarios, que tienen su cuenca de drenaje en terrenos con alto contenido de sales minerales. Entre estos tributarios tenemos a la quebrada Mishquiyacu que tiene salinidad moderada (4 a 4.360/00). Asimismo, la laguna Limón presenta salinidad alta (24.90/00) cercanas a las encontradas en el mar. Esta característica permite que otros parámetros, como la conductividad eléctrica, cloruros y la dureza total se encuentren ostensiblemente elevados (Tabla 5.3). Sin embargo, se puede notar la presencia de una variada fauna ictiológica en estos cuerpos de agua que faltaría ser evaluada.
Con excepción de los elevados niveles de salinidad, cloruros y dureza total en la laguna Limón y en algunos tributarios menores, como las quebradas Mishquiyacu y Sacanche entre otros, las características físicas y químicas de los cuerpos de agua estudiados son semejantes a las reportadas por Guerra et al (1990) para los ríos del
llano amazónico y por Chapman et al (1971) en río Kafue, como ejemplo de los ríos de Africa de donde es oriunda la "tilapia".
Tabla 5.3. Parámetros físicos y químicos de los diferentes cuerpos de agua muestreados.
| Cuerpo de agua |
Temperatura°C
|
pH
|
Salinidad ‰
|
Conductividad
mmhos/cm |
Oxígeno disuelto mg/l
|
Cloruros mg/l
|
Dureza
mg/l |
|||
| Periodo | Creciente | Vaciante |
Creciente
|
Vaciante
|
Creciente
|
Vaciante
|
Vaciante | Vaciante | Vaciante | Vaciante |
| 1.R.Huallaga – Juanjui |
23.1
|
27.8
|
8
|
7.5
|
1
|
0.15
|
295
|
7.1
|
83
|
105.5
|
| 2.R.Huallaga 2 |
25.7
|
27.8
|
8
|
7.5
|
0.5
|
0.14
|
290
|
6.8
|
80
|
111.2
|
| 3.R. Huallaga 3 |
27
|
26.3
|
8
|
7.5
|
0
|
0.18
|
310
|
6.9
|
100
|
85.5
|
| 4.Caño ajo |
26
|
31.4
|
7.2
|
7.1
|
1
|
0.94
|
2,180
|
10.1
|
520
|
444
|
| 5.R. Saposoa |
33
|
22.9
|
6.6
|
7.6
|
1
|
0.3
|
540
|
6.8
|
160
|
239.4
|
| 6.Qda Sacanche |
34
|
24.3
|
6.5
|
7.4
|
1
|
0.87
|
1,840
|
7.2
|
480
|
273.6
|
| 7.R.Sisa Medio |
28
|
26.7
|
6.5
|
7.4
|
1
|
0.13
|
275
|
6.9
|
70
|
119.7
|
| 8.Represa S.Pablo |
29.7
|
28.6
|
6.5
|
7.3
|
2.5
|
0.11
|
280
|
6.9
|
60
|
111.2
|
| 9.R. Sisa Bajo |
28
|
28.8
|
6.5
|
7.4
|
1
|
0.14
|
670
|
7.2
|
80
|
222.3
|
| 10.Tributarios-R. Sisa Bajo |
29.5
|
24.9
|
6.5
|
6.7
|
2
|
0.36
|
1,020
|
0.8
|
200
|
239.4
|
| 11.Qda. Mishquiyacu |
26.5
|
28.8
|
7.5
|
7.8
|
4
|
4.36
|
8,300
|
8
|
2,400
|
342
|
| 12.Lago Sauce |
25.5
|
28.8
|
7.5
|
8.2
|
2
|
0.4
|
843
|
7.8
|
220
|
102.6
|
| 13.R. Alto Mayo |
23
|
23.3
|
6.6
|
7.3
|
1
|
0.11
|
320
|
6.1
|
60
|
145.3
|
| 14. R.Tónchima |
22.5
|
24.3
|
6.6
|
7.4
|
3
|
0.11
|
450
|
6.6
|
60
|
188.1
|
| 15. Represa Mashuyacu |
28
|
25.3
|
6.8
|
6.6
|
1
|
0.04
|
70
|
4.8
|
20
|
34.2
|
| 16.R. Indoche |
23.3
|
24.4
|
6.5
|
7.4
|
0
|
0.11
|
350
|
6.2
|
60
|
119.7
|
| 17.Represa del Gera |
23.5
|
21
|
6.3
|
7.1
|
0
|
0.14
|
150
|
6.4
|
80
|
17.1
|
| 18.R. Gera – boca |
23
|
22
|
6.3
|
7.8
|
0
|
0.04
|
220
|
7.8
|
20
|
85.5
|
| 19.R. Cumbaza-S.Antonio |
23
|
26.4
|
6.5
|
9.1
|
0.5
|
0.07
|
110
|
8.4
|
40
|
51.3
|
| 20.R. Cumbaza-J. Guerra |
30.5
|
33
|
6.6
|
8.8
|
0.12
|
0.11
|
400
|
8.5
|
40
|
104
|
| 21.Qda. Ahuashiyacu |
26
|
27.5
|
6.6
|
8.8
|
2
|
0.11
|
260
|
8.1
|
40
|
119.7
|
| 22.Qda. Pucayacu |
29
|
30.7
|
6.6
|
8.8
|
0
|
0.11
|
240
|
7.7
|
40
|
119.7
|
| 23.Rio Shanusi |
26
|
|
6.9
|
|
0
|
|
|
|
|
|
| 24.R. Yuracyacu |
26
|
|
6.9
|
|
0
|
|
|
|
|
|
| 25.R. Huallabamba(boca) |
21.5
|
25.7
|
6.5
|
7.4
|
1
|
0.11
|
230
|
7.9
|
60
|
102.6
|
| 26. Laguna Limón |
|
29.8
|
|
8
|
|
24.9
|
48,300
|
8
|
13,800
|
1,539.00
|
Tabla 5.4. Características físicas, químicas e hídricas de cuerpos de agua del área de estudio. 1981.
| Cuerpos de agua |
Río Huallaga Juanjui |
Río Huallaga (Bellavista)
|
Río Huallaga (Picota)
|
Río Huallaga (Vaquero)
|
Río Saposoa
|
Río Sisa
|
Qda. Mishqui-yacu
|
Laguna Sauce
|
| Fecha |
15/10/81
|
15/10/81
|
14/10/81
|
Jul-Ag-81
|
27/10/81
|
28/10/81
|
Jul-Ag-81
|
Ag-Set-81
|
| Transparencia % |
5
|
20
|
5
|
15-60
|
10
|
10
|
100
|
70-100
|
| Color aparente |
8
|
7
|
8
|
05-Jul
|
8
|
7
|
01-Abr
|
01-May
|
| Temperatura Agua °C |
23.8
|
25
|
28.5
|
23.5-27.5
|
26.2
|
25.5
|
22.5-24
|
25-27.1
|
| PH |
6
|
6.5
|
6.5
|
6
|
6.5
|
6
|
6.5
|
6-6.5
|
| Oxígeno disuelto mg/l |
5.07
|
5.27
|
4.7
|
7.05-7.92
|
5.79
|
5.54
|
8.64-8.87
|
5.08-5.12
|
| Anhi. Carbón. Libre mg/l |
1
|
2
|
1.5
|
0.06-1.5
|
1
|
0.5
|
0-4
|
0-0.5
|
| Alcalin. Fenolfta. Mg/l |
0
|
0
|
0
|
0
|
0
|
0
|
0-3
|
0-5
|
| Alcalinidad total mg/l |
35
|
32
|
36
|
25-33
|
38
|
43
|
40.5-56
|
22.5-54
|
| Bicarbonatos mg/l |
35
|
32
|
36
|
25-33
|
38
|
43
|
40.5-50
|
22.5-44
|
| Carbonatos mg/l |
0
|
0
|
0
|
0
|
0
|
0
|
0-6
|
0-10
|
| Dureza total mg/l |
40.3
|
28
|
44
|
78-102
|
40
|
36
|
118-150
|
75-175
|
| Dureza de Ca mg/l |
0.8
|
0.4
|
0.2
|
0.8-2.4
|
0.4
|
0.4
|
0.8-1.6
|
0.8-1.6
|
| Dureza de Mg mg/l |
39.5
|
27.6
|
43.8
|
76.8-101
|
39.6
|
35.6
|
117-148
|
73-173
|
| Tipo de fondo |
pedrego.
|
Areno-pedreg.
|
Areno-fang-pedr
|
Pedrego.
|
pedrego.
|
areno- limoso
|
pedrego.
|
Arcilloso-pedregoso
|
| Corriente |
fuerte
|
fuerte
|
moderada
|
fuerte
|
fuerte
|
moderada
|
lenta
|
-
|
Fuente: Ministerio de Pesquería-San Martín. 1982.
Tabla 5.5. Características físicas, químicas e hidrológicas de cuerpos de agua del área de estudio. 1979-1980.
| Cuerpos de agua |
Río Huallaga
|
Río Huallabamba
|
Río Saposoa
|
Río Sisa
|
Río Mayo
|
||
| Fecha |
Oc-Dic-79
|
Ab-No-80
|
Oc-Dic-79
|
Ab-No-80
|
Oc-Dic-79
|
Oc-Dic-79
|
Ab-No-80
|
| Transparencia % |
18
|
64
|
40
|
43
|
20
|
12
|
46
|
| Color aparente |
06-Jul
|
05-Jul
|
04-Ago
|
01-Ago
|
06-Jul
|
06-Jul
|
04-Ago
|
| Temperatura Agua °C |
26
|
25
|
22.6
|
23.9
|
30.5
|
30
|
25.1
|
| PH |
6.4
|
6.1
|
6.8
|
6
|
6.5
|
6.5
|
6.5
|
| Oxígeno disuelto mg/l |
5.61
|
7.93
|
5.72
|
8.8
|
4.33
|
3.47
|
8.13
|
| Anhi. Carbón. Libre mg/l |
3.41
|
0.8
|
1.27
|
0.25
|
1.25
|
0
|
1.2
|
| Alcalinidad fenolfta. mg/l |
0
|
0
|
0
|
0
|
0
|
10
|
1.16
|
| Alcalinidad total mg/l |
47.5
|
64.3
|
75.25
|
72
|
100
|
120
|
75.33
|
| Bicarbonatos mg/l |
47.5
|
64.3
|
75.25
|
72
|
100
|
100
|
74.17
|
| Carbonatos mg/l |
0
|
0
|
0
|
0
|
0
|
20
|
1.16
|
| Dureza total mg/l |
74.33
|
93.3
|
96.5
|
111
|
151
|
138
|
111.33
|
| Dureza de Ca mg/l |
1.5
|
1.4
|
1.2
|
2.8
|
1.6
|
2.4
|
2
|
| Dureza de Mg mg/l |
72.83
|
91.9
|
95.3
|
108.2
|
149.4
|
135.6
|
109.33
|
| Cloruros mg/l |
|
12.47
|
|
5.56
|
|
|
17.83
|
| Tipo de fondo |
Pedrego-arenoso
|
Areno-arcilloso
|
Pedrego.
|
Pedrego.
|
Pedrego-arenoso
|
Arcilloso-arenoso
|
Areno-pedrego.
|
Fuente: Ministerio de Pesquería - San Martín. 1982.
Tabla 5.6. Características físicoquímicas de las aguas superficiales de la zona de estudio según ONERN (1984).
| Estaciones |
Temperatura
|
Oxigeno
|
CO2
|
PH
|
Turbidez
|
Conductividad
|
Sólidos disueltos totales
|
Dureza total
|
|
°C
|
mg/lt
|
mg/lt
|
|
FTU
|
mmhos xcm
|
mg/lt
|
mg/lt
|
|
| Río Huallaga (Shapaja |
27
|
7.2
|
4
|
8
|
45
|
0.3
|
204
|
90
|
| Río Huallaga (Juanjui) |
25
|
6.7
|
5.5
|
8.1
|
30
|
0.24
|
180
|
80
|
| Río Mayo Pte Colombia |
27.5
|
6.5
|
0.5
|
7.7
|
50
|
0.34
|
264
|
133
|
| Río Mayo-Pte Colombia |
24.5
|
7.2
|
2
|
8.1
|
100
|
0.29
|
218
|
110
|
| Río Cumbaza –Morales |
29.5
|
6.4
|
0
|
8.2
|
0
|
0.12
|
96
|
50
|
| Qda Ahuashiyacu-Pte |
31.5
|
6.7
|
1.2
|
8.1
|
0
|
0.18
|
146
|
80
|
| Río Sisa –Pte |
30
|
6.4
|
1.2
|
8.1
|
0
|
0.18
|
146
|
80
|
| Río Sisa -S.Pablo |
27
|
7
|
4
|
8.3
|
47
|
0.4
|
291
|
137
|
| Río Saposoa-Pte |
29
|
7.3
|
5.5
|
8.2
|
140
|
0.69
|
468
|
150
|
| Qda Sacanche |
29
|
8.7
|
6.45
|
8.3
|
0
|
1.75
|
1.035
|
253
|
| Río Huallabamba |
22
|
7
|
1
|
8.1
|
92
|
0.22
|
162
|
90
|
5.2. AMBIENTE BIOLOGICO
5.2.1. COMUNIDADES ICTICAS
5.2.1.1.- Composición por especies,
En los ambientes acuáticos muestreados se registraron 88 especies, de acuerdo a la clasificación señalada por Ortega & Vari (1986) y las modificaciones de Ortega (1991) y Chang & Ortega (1995); distribuidas en 22 familias, 18 en la I fase y 17 en la II fase (tabla 5.7). Representantes de las familias Auchenipteridae, Sternopigidae, Anastomidae, Apteronidae, y Symbranchidae, que aparecen en los muestreos de aguas altas no se reportan para el periodo de aguas bajas; pero aparecen otras, como Rivulidae, Paradontidae, Gasteropelecidae y Cyprinidae; esta última con la especie exótica Cyprinus carpio, encontrada en el embalse de Mashuyacu, donde se ha sembrado deliberadamente.
De acuerdo al número de especies, destacan claramente las familias Characidae, Pimelodidae, Loricaridae y Cichlidae, para ambos periodos de muestreo, con escasas diferencias entre ambos; sobresaliendo la primera con 22 y 29 especies para aguas altas y aguas bajas, respectivamente (tabla 5.7)
Algunas de las familias "pobremente" representadas, involucran a importantes especies, que por su bajo número, pasan desapercibidas y con ello el nicho ecológico que ocupan podría citarse como vacante o subocupada. Sin embargo, el número de ejemplares es significativo, y su rol en el ecosistema es decisivo. En este caso tenemos a: Trichomycteridae que agrupa a los caneros, peces hematófagos de decisiva presencia en el ecosistema; Poecilidae con su especie Poecilia reticulata, pez introducido como controlador biológico de la malaria y que, por otro lado, fue el más abundante en número; Erythrinidae, con su especie Hoplias malabaricus "fasaco", de amplia distribución en las cuencas sudamericanas, y que es uno de los carnívoros más conspicuos de los cuerpos de agua de la región; Symbranchidae con la especie Symbranchus marmoratus "atinga", también de régimen carnívoro. Sólo se reporta para el periodo de aguas altas.
Tabla 5.7. Número y porcentaje de especies por familia encontradas en los dos periodos de muestreo.
| Familia |
Numero de especies
|
Porcentaje
|
||
|
I fase
|
II fase
|
I fase
|
II fase
|
|
| Characidae |
22
|
29
|
37.3
|
45.3
|
| Pimelodidae |
8
|
4
|
13.5
|
6.3
|
| Loricariidae |
7
|
9
|
11.8
|
14.1
|
| Cichlidae |
5
|
5
|
8.5
|
7.8
|
| Trichomycteridae |
2
|
2
|
3.4
|
3.1
|
| Auchenipteridae |
2
|
|
3.4
|
|
| Sternopygidae |
2
|
|
3.4
|
|
| Poecilidae |
1
|
1
|
1.7
|
1.6
|
| Anastomidae |
1
|
|
1.7
|
|
| Erythrinidae |
1
|
1
|
1.7
|
1.6
|
| Belonidae |
1
|
1
|
1.7
|
1.6
|
| Apteronitidae |
1
|
|
1.7
|
|
| Curimatidae |
1
|
3
|
1.7
|
4.7
|
| Prochilodontidae |
1
|
2
|
1.7
|
3.1
|
| Callichthyidae |
1
|
1
|
1.7
|
1.6
|
| Symbranchidae |
1
|
|
1.7
|
|
| Engraulidae |
1
|
1
|
1.7
|
1.6
|
| Aspredinidae |
1
|
1
|
1.7
|
1.6
|
| Rivulidae |
|
1
|
|
1.6
|
| Paradontidae |
|
1
|
|
1.6
|
| Cyprinidae |
|
1
|
|
1.6
|
| Gasteropelecidae |
|
1
|
|
1.6
|
| TOTAL |
59
|
64
|
|
|
Los pescadores de los poblados ribereños del río Huallaga reportan la presencia de especies como: Prochilodus nigricans, Raphyodon vulpinus, Pseudoplatystoma fasciatum, Zungaro zungaro, Colossoma macropomum, Hoplias malabaricus, Brycon erythropterum, Leporinus sp, entre otros. En los tributarios mayores, como los ríos Huayabamba, Saposoa, Sisa y Mayo se presentan las mismas especies citadas para el Huallaga, especialmente cerca a la desembocadura, pero en menor cantidad. Esta información es reportada también por Correa y Colaboradores (1980).
En otro aspecto, la diversidad íctica, referida por el número de especies de los ambientes muestreados, presenta un rango muy amplio, que va desde dos especies en la represa del Gera, en aguas altas, igualmente dos para el río Tónchima, boca del Gera, y laguna Limón, en aguas bajas; hasta 34 en el río Huallaga a la altura de Juanjui en aguas altas y 30 en el mismo río a la altura de Chazuta, en aguas bajas (tabla 5.8). Por el momento no se visualizan características condicionantes a la menor o mayor diversidad; aunque, en el periodo de aguas bajas los valores menores se han registrado en ambientes lénticos intervenidos, como en la, represa del Gera, el embalse de Mashuyacu, lago Sauce y en la represa de san Pablo, con 2, 4, 6 y 9 especies, respectivamente. Si embargo, en el periodo contrastante los valores más bajos se registraron en ambientes disimiles como en la boca del río Gera (quebrada), río Tónchima (río mediano) y en la laguna Limón, con dos especies en cada una de ellos.
En el otro extremo, para el periodo de aguas altas, los valores más altos de diversidad específica se reportan para el río Huallaga a la altura de Juanjui y a la altura de Mishquiyacu, con 34 y 24 especies, respectivamente. Para el periodo de vaciante, la mayor diversidad ocurre en el mismo río, a la altura de Chazuta con 30 especies y a la altura de Juanjui, con 23 especies. Otros ambientes de agua corriente, pero de menor magnitud (quebrada, caño y río mediano) siguen a los anteriores en cuanto a diversidad íctica, para ambos periodos de muestreo. Como se observa, en este caso, la diferencia de estos ambientes se presenta desde la magnitud, que va de un río grande, como el Huallaga, a una quebrada como el Ahuashiyacu o los tributarios del Bajo Sisa. Obviamente, la fisiología de los mismos ha de ser diferente.
Considerando que la diversidad por especies es una función de la intensidad del muestreo (Allen, 1996) se ha ensayado con otros índices de diversidad, como: el número de especies por el número de ejemplares y el número de especies por la abundancia. De esta forma se encontró que, los ambientes con mayor diversidad son el río Huallaga a la altura de Juanjui, la quebrada de Sacanche y el río Huallaga a la altura de Chazuta, para el primer caso; en tanto que para el segundo son la quebrada de Sacanche, río Huallaga a la altura de Chazuta y el río Saposoa (tabla 5.8).
5.2.1.2.-Ocurrencia de especies más frecuentes
El Carácido de porte pequeño Knodus sp fue la especie más frecuente, en ambos periodos de muestreo, presentándose en 18 ambientes de 24 y 25 muestreados en la I y II fase, respectivamente. Otros caracídeos de porte pequeño, del grupo de la "mojarras", al igual que el Knodus sp, como Astyanax sp, Cheirodon sp, Bryconamericus sp, Paragoniates alburnus, Ptenobrycon sp entre otros, también estuvieron presentes en más de diez ambientes muestreados durante las dos fases del estudio. Hypostomus sp, y Bujurquina huallagae pertenecientes a las familias Loricaridae y Cichlidae, respectivamente, también se califican como especies muy frecuentes al estar presentes en más de 11 ambientes muestreados en ambas fases (tablas 5.9 y 5.10)
El "gupy" Poecilia reticulata, especie introducida, estuvo presente en 16 ambientes acuáticos muestreados (once en cada fase). En tanto que otra especie introducida la "tilapia del Nilo" Oreochromis niloticus fue reportada en 7 ambientes (cuatro en la primera y seis en la segunda). La "carpa común" Cyprinus carpio fue encontrada sólo en Mashuyacu en la segunda fase, llegó a este ambiente por siembra deliberada (tablas 5.9 y 5.10).
Tabla 5.8. Riqueza de especies de los ambientes acuáticos
muestreados
| Ambiente acuático |
Especies
|
Ejemplares
|
Lances
|
Especie/lance
|
Abundancia
|
Especies x abunda.
|
|
|
Nombre
|
categ.
|
||||||
| 1. Huallaga-1 |
RG
|
23
|
2,316
|
36
|
0.64
|
25
|
575
|
| 2. Huallaga-2 |
RG
|
14
|
974
|
20
|
0.7
|
30
|
420
|
| 3. Huallaga-3 |
RG
|
30
|
670
|
31
|
0.97
|
23
|
690
|
| 4. Caño. Ajo |
CÑ
|
14
|
185
|
10
|
1.4
|
38
|
392
|
| 5. Saposoa |
RM
|
15
|
113
|
5
|
3
|
46
|
690
|
| 6. Sacanche |
QD
|
16
|
1,338
|
10
|
1.6
|
82
|
1312
|
| 7. Sisa medio |
RM
|
16
|
328
|
21
|
0.76
|
23
|
368
|
| 8. San. Pablo |
LG
|
14
|
1,359
|
10
|
1.4
|
49
|
686
|
| 9. Sisa bajo |
RM
|
13
|
404
|
11
|
1.18
|
23
|
299
|
| 10. Sisa Tributar |
CÑ
|
9
|
385
|
9
|
1
|
22
|
198
|
| 11. Mishquiyacu |
QD
|
6
|
119
|
10
|
0.6
|
5
|
30
|
| 12. Sauce |
LG
|
6
|
140
|
30
|
0.2
|
77
|
462
|
| 13. Mayo alto |
RM
|
11
|
516
|
20
|
0.55
|
19
|
209
|
| 14. Tónchima |
RM
|
2
|
119
|
11
|
0.18
|
11
|
22
|
| 15. Mashuyacu |
LG
|
7
|
1,285
|
10
|
0.7
|
47
|
329
|
| 16. Indoche |
RM
|
7
|
72
|
12
|
0.58
|
10
|
70
|
| 17. Río Gera |
LG
|
5
|
29
|
10
|
0.5
|
16
|
80
|
| 18. Boca Gera |
QD
|
2
|
36
|
10
|
0.2
|
2
|
4
|
| 19. Cumbaza SA |
QD
|
5
|
14
|
8
|
0.62
|
6
|
30
|
| 20. Cumbaza JG |
RM
|
15
|
255
|
20
|
0.75
|
14
|
210
|
| 21. Ahuashiyacu |
QD
|
16
|
566
|
22
|
0.73
|
36
|
576
|
| 22. Pucayacu |
QD
|
17
|
187
|
15
|
1.13
|
21
|
357
|
| 23. Huayabamba |
RM
|
7
|
150
|
4
|
1.75
|
24
|
168
|
| 24. Limoncocha |
LG
|
2
|
85
|
10
|
0.2
|
17
|
34
|
| 25. Mayo bajo |
RM
|
7
|
114
|
10
|
0.7
|
6
|
42
|
Categoría: RG: río grande; RM: río mediano; QD: quebrada; CÑ: caño y LG: laguna
Tabla 5.9 Ocurrencia de principales especies en ambientes
acuáticos muestreados en época de creciente, nov-dic/97
| Especies |
E s t a c i o n e s
|
,A | ,B | ,C | Total | |||||||||||||||||||||||
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
22
|
23
|
24
|
|||||
| Oreochromis niloticus |
|
|
|
|
|
|
|
|
|
C
|
|
A
|
|
|
B
|
|
|
|
|
B
|
|
|
|
|
1
|
2
|
1
|
4
|
| Poecilia reticulata |
A
|
|
|
A
|
|
C
|
C
|
|
|
C
|
|
A
|
|
C
|
A
|
|
A
|
C
|
|
|
C
|
|
|
|
6
|
|
5
|
11
|
| Bujurquina huallagae |
C
|
|
|
C
|
C
|
C
|
B
|
|
|
C
|
|
C
|
|
|
A
|
|
|
|
C
|
C
|
C
|
C
|
|
|
10
|
1
|
|
11
|
| Hypostomus sp |
C
|
|
|
C
|
C
|
|
C
|
C
|
C
|
C
|
|
B
|
C
|
|
|
C
|
|
C
|
|
|
C
|
|
|
C
|
12
|
11
|
|
13
|
| Bryconamericus sp |
|
B
|
B
|
|
A
|
C
|
A
|
|
|
C
|
C
|
B
|
C
|
C
|
|
|
|
|
|
|
A
|
C
|
C
|
|
7
|
3
|
3
|
13
|
| Astyanax sp |
B
|
C
|
|
A
|
|
A
|
C
|
C
|
C
|
B
|
B
|
C
|
C
|
|
|
C
|
|
C
|
|
C
|
C
|
C
|
|
|
11
|
3
|
2
|
16
|
| Knodus sp |
A
|
B
|
B
|
A
|
A
|
A
|
A
|
B
|
A
|
C
|
A
|
|
|
|
|
|
|
A
|
B
|
A
|
A
|
B
|
B
|
A
|
1
|
5
|
12
|
18
|
| Ctenobrycon sp |
C
|
C
|
|
A
|
|
B
|
C
|
B
|
C
|
B
|
B
|
|
|
|
|
|
|
|
|
C
|
C
|
|
|
C
|
7
|
4
|
1
|
12
|
| Creagrutus sp |
C
|
|
|
|
|
|
C
|
|
|
|
C
|
|
C
|
C
|
|
C
|
|
C
|
C
|
|
C
|
|
|
C
|
10
|
|
|
10
|
| Oloshestes sp |
C
|
C
|
|
|
|
C
|
|
|
|
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
4
|
| Galeocharax gulo |
C
|
B
|
C
|
C
|
|
C
|
C
|
|
|
|
C
|
|
|
|
|
|
|
|
|
|
C
|
|
|
|
7
|
1
|
|
8
|
| Cheyrodon sp |
B
|
A
|
C
|
A
|
C
|
|
C
|
B
|
|
C
|
C
|
|
|
|
|
|
|
C
|
|
C
|
B
|
C
|
|
A
|
7
|
3
|
4
|
14
|
| Henonemus taxistigmus |
C
|
B
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
2
|
1
|
|
3
|
| Aphyocharax sp |
C
|
C
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
|
|
|
C
|
C
|
6
|
|
|
6
|
| Cichlasoma sp |
|
C
|
|
C
|
|
|
C
|
|
C
|
|
|
|
|
|
|
|
|
C
|
|
C
|
C
|
|
|
C
|
8
|
|
|
8
|
| Crenicichla sp |
|
C
|
|
C
|
|
C
|
C
|
|
C
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
7
|
|
|
7
|
| Serrasalmus sp |
|
C
|
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
|
|
|
|
|
|
|
|
|
C
|
C
|
|
|
C
|
11
|
|
|
11
|
| Characidium sp |
C
|
|
|
A
|
|
C
|
|
C
|
|
C
|
|
|
|
|
|
|
|
|
C
|
|
|
|
|
C
|
6
|
|
1
|
7
|
| Paragoniates alburnus |
B
|
|
|
B
|
C
|
C
|
B
|
C
|
C
|
C
|
|
|
|
|
|
|
|
C
|
|
|
C
|
C
|
C
|
C
|
11
|
2
|
|
13
|
| Odontostilbe sp |
B
|
|
|
A
|
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B
|
|
|
1
|
2
|
1
|
4
|
| Steindachnerina sp |
C
|
|
C
|
B
|
|
|
|
|
|
C
|
|
|
|
|
|
C
|
A
|
|
|
C
|
C
|
C
|
|
C
|
9
|
1
|
1
|
11
|
| Ancistrus sp |
|
|
|
C
|
|
|
|
|
|
C
|
|
|
|
|
C
|
C
|
|
C
|
|
|
C
|
|
|
|
5
|
|
|
5
|
| Scophaeocharax rhinodus |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
C
|
|
|
|
2
|
|
|
2
|
| Ceratobranchia sp |
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
|
|
|
B
|
|
|
C
|
|
|
A
|
2
|
1
|
1
|
4
|
| Prionobrama filigera |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
|
|
|
C
|
|
2
|
|
|
2
|
| Otros |
18
|
12
|
3
|
8
|
7
|
5
|
5
|
1
|
7
|
7
|
3
|
|
6
|
|
|
1
|
|
15
|
|
3
|
9
|
3
|
4
|
8
|
|
|
|
|
|
A
|
11
|
7
|
3
|
7
|
5
|
10
|
10
|
5
|
7
|
13
|
5
|
2
|
5
|
3
|
1
|
5
|
0
|
1
|
4
|
7
|
14
|
6
|
5
|
10
|
|
|
|
|
|
B
|
3
|
4
|
2
|
2
|
0
|
1
|
2
|
3
|
0
|
2
|
2
|
2
|
0
|
0
|
1
|
0
|
0
|
1
|
1
|
1
|
1
|
2
|
1
|
0
|
|
|
|
|
|
C
|
2
|
1
|
1
|
7
|
2
|
2
|
2
|
0
|
1
|
0
|
1
|
2
|
0
|
0
|
2
|
0
|
2
|
1
|
0
|
1
|
2
|
0
|
0
|
3
|
|
|
|
|
|
TOTAL
|
34
|
24
|
9
|
24
|
14
|
18
|
19
|
9
|
15
|
22
|
11
|
6
|
10
|
3
|
4
|
6
|
2
|
18
|
5
|
12
|
26
|
11
|
10
|
21
|
|
|
|
|
LEYENDA: C= Menos de 20 ejemplares; B= de 21 a 50 ejemplares; A= más de 50 ejemplares
Tabla 5.10. Ocurrencia de principales especies en ambientes acuáticos muestreados en época de vaciante, sept/98
|
E s t a c i o n e s
|
|||||||||||||||||||||||||||||
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
22
|
23
|
24
|
25
|
A
|
B
|
C
|
Total
|
|
| Astyanax bimaculatus |
C
|
C
|
C
|
A
|
B
|
|
B
|
C
|
A
|
A
|
|
B
|
|
|
|
|
|
|
|
|
C
|
C
|
|
|
|
3
|
3
|
6
|
12
|
| Oreochromis niloticus |
|
|
|
|
|
|
|
|
|
|
|
A
|
A
|
|
B
|
|
|
|
|
C
|
C
|
|
|
A
|
|
3
|
1
|
2
|
6
|
| Poecilia reticulata |
|
|
C
|
C
|
|
C
|
|
|
C
|
A
|
|
B
|
A
|
|
A
|
C
|
|
|
|
|
C
|
|
|
C
|
|
3
|
1
|
7
|
11
|
| Crenicichla sp |
C
|
C
|
C
|
C
|
C
|
C
|
C
|
B
|
C
|
|
|
|
|
|
|
|
C
|
|
|
C
|
|
C
|
|
|
|
|
1
|
11
|
12
|
| Hypostomus sp |
B
|
C
|
C
|
C
|
C
|
C
|
C
|
A
|
|
|
|
|
C
|
|
|
C
|
|
|
|
|
C
|
|
C
|
|
C
|
1
|
1
|
11
|
13
|
| Aphyocharax sp |
C
|
|
A
|
|
|
C
|
|
|
|
|
C
|
|
|
|
|
|
|
|
|
|
|
|
C
|
|
|
1
|
|
4
|
5
|
| Characidium sp |
B
|
C
|
C
|
|
C
|
B
|
C
|
|
C
|
C
|
|
|
|
|
|
|
C
|
|
|
C
|
|
|
|
|
|
|
2
|
8
|
10
|
| Cheirodon sp |
B
|
A
|
A
|
C
|
C
|
B
|
|
C
|
C
|
A
|
C
|
|
C
|
|
|
|
|
|
|
B
|
A
|
A
|
C
|
|
B
|
5
|
4
|
7
|
16
|
| Creagrutus sp |
C
|
|
C
|
|
|
|
C
|
|
|
|
|
|
A
|
|
|
C
|
|
|
C
|
|
C
|
C
|
|
|
|
1
|
|
7
|
8
|
| Bryconamericus sp |
A
|
A
|
A
|
|
C
|
|
|
C
|
C
|
C
|
A
|
|
|
A
|
|
|
|
|
C
|
C
|
A
|
C
|
B
|
|
|
6
|
1
|
7
|
14
|
| Knodus sp |
A
|
A
|
C
|
C
|
C
|
A
|
C
|
C
|
C
|
|
|
|
C
|
|
|
B
|
|
B
|
C
|
A
|
A
|
A
|
C
|
|
C
|
6
|
2
|
10
|
18
|
| Serrasalmus sp |
C
|
C
|
C
|
|
C
|
|
B
|
A
|
C
|
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
1
|
6
|
8
|
| Ctenobrycon sp |
C
|
|
|
C
|
C
|
|
|
A
|
|
C
|
|
|
|
|
|
|
|
|
|
C
|
|
|
|
|
C
|
1
|
|
6
|
7
|
| Astyanax sp |
C
|
C
|
C
|
|
C
|
|
C
|
|
|
C
|
|
|
A
|
C
|
C
|
C
|
|
|
|
C
|
B
|
C
|
|
|
|
1
|
1
|
10
|
12
|
| Bujurquina huallagae |
C
|
B
|
|
|
C
|
|
A
|
C
|
C
|
C
|
|
|
A
|
|
|
B
|
C
|
|
C
|
C
|
A
|
C
|
|
|
|
3
|
2
|
10
|
15
|
| Cichlasoma sp |
C
|
|
C
|
C
|
|
|
C
|
C
|
C
|
|
|
|
|
|
C
|
|
|
|
|
C
|
|
|
|
|
|
|
|
8
|
8
|
| Hoplias malabaricus |
C
|
|
|
C
|
C
|
|
C
|
C
|
C
|
|
|
|
|
|
|
|
C
|
|
|
|
|
C
|
|
|
C
|
|
|
9
|
9
|
| Pimelodella sp |
|
|
C
|
|
|
C
|
|
|
|
|
|
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
3
|
| Steindachnerina sp |
|
C
|
C
|
|
C
|
C
|
|
|
|
|
|
|
C
|
|
C
|
|
|
C
|
|
|
|
|
|
|
|
|
|
7
|
7
|
| Paragoniates alburnus |
|
|
|
C
|
|
C
|
B
|
A
|
C
|
|
C
|
|
|
|
|
|
C
|
|
|
|
|
C
|
|
|
|
1
|
1
|
6
|
8
|
| Scophaeocharax sp |
|
|
|
|
|
C
|
|
|
C
|
|
|
|
|
|
|
|
|
|
C
|
|
C
|
C
|
|
|
|
|
|
5
|
5
|
| Galeocharax gulu |
|
|
C
|
|
C
|
|
B
|
C
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
3
|
4
|
| Roeboides sp |
|
|
|
|
C
|
|
|
A
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
|
1
|
|
2
|
3
|
| Serrasalmus sp A |
|
|
|
B
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
1
|
| Steindac. Guntheri |
|
|
C
|
|
|
|
|
|
|
A
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
1
|
2
|
| Astyanacinus sp |
|
|
|
|
|
|
|
|
|
|
|
|
B
|
|
|
|
|
|
|
|
A
|
C
|
|
|
|
1
|
1
|
1
|
3
|
| Prionobrama sp |
|
|
B
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
1
|
| Callychthys callychthys |
|
|
|
|
|
|
|
|
|
|
|
B
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
|
1
|
| Otros |
8
|
3
|
12
|
3
|
0
|
5
|
3
|
0
|
0
|
0
|
1
|
2
|
0
|
0
|
2
|
1
|
0
|
0
|
0
|
5
|
4
|
5
|
2
|
0
|
1
|
|
|
|
|
| A |
2
|
3
|
3
|
1
|
-
|
1
|
1
|
5
|
1
|
4
|
1
|
1
|
5
|
1
|
1
|
-
|
-
|
-
|
-
|
1
|
5
|
2
|
-
|
1
|
0
|
|
|
|
|
| B |
3
|
1
|
1
|
1
|
1
|
2
|
4
|
1
|
-
|
-
|
0
|
3
|
1
|
-
|
1
|
2
|
-
|
1
|
-
|
1
|
1
|
-
|
1
|
-
|
1
|
|
|
|
|
| C |
10
|
7
|
14
|
9
|
14
|
8
|
8
|
8
|
12
|
5
|
4
|
-
|
5
|
1
|
3
|
4
|
3
|
1
|
5
|
8
|
6
|
10
|
4
|
1
|
5
|
|
|
|
|
| TOTAL |
23
|
14
|
30
|
14
|
15
|
16
|
16
|
14
|
13
|
9
|
6
|
6
|
11
|
2
|
7
|
7
|
5
|
2
|
5
|
15
|
16
|
17
|
7
|
2
|
7
|
|
|
|
|
LEYENDA: C= Menos de 20 ejemplares; B= de 21 a 50 ejemplares; A= más de 50 ejemplar.
5..2.1.- Abundancia
La abundancia de un recurso es la representación directa de su biomasa; sin embargo ante la dificultad de calcular esta magnitud se usa frecuentemente índices que son la representación de lo que acontece en un ecosistema particular. En pesquerías, la captura por unidad de esfuerzo es el índice de abundancia más empleado, sobre la base de la cual se han manejado y se manejan importantes recursos.
Por analogía, para el presente estudio, se usa un índice resultante de dividir la biomasa (captura) entre el número de lances (representación del esfuerzo), con la finalidad de comparar la abundancia de los diversos ambientes acuáticos que fueron muestreados.
Como es obvio, la variabilidad de abundancia, expresada en gramos por lance (g/lance), de los distintos ambientes acuáticos muestreados, es muy alto. El rango se desplaza de valores tan bajos como 2 hasta 79.2 g/lance, en el periodo de aguas altas; y de 2.4 hasta 81.6 g/lance en el periodo de vaciante (Tabla 5.11).
En el muestreo de aguas altas, tres ambientes intervenidos registran los más altos valores del índice de abundancia, dos de los cuales son ambientes lénticos, la represa del Gera con 79.2 g/lance y el embalse de Mashuyacu con 55.8 g/lance. En el tercer ambiente, el caño Potochico (tributario del Bajo Sisa) la abundancia llega a 63.7 g/lance. Conviene resaltar en este punto, que los ambientes lénticos citados tienen una baja diversidad íctica con dos y cuatro especies, respectivamente, en tanto que el ambiente lótico, tiene una alta diversidad, con 22 especies. Los valores más bajos, aparentemente, no correlacionan con un patrón determinado; así, encontramos estos valores en el Tónchima (río mediano), con 2 g/lance; Cumbaza San Antonio (quebrada), con 3.4/ g/lance; San Pablo (laguna), con 4.5 g/lance. Podríase, sin embargo, caracterizar a los dos primeros ambientes como de corriente rápida, de fondo rocoso, piedras y graba, lo que Welcomme denomina "ritrón". Por causas que se desconoce, la represa de San Pablo, tiene una muy baja abundancia, 4.5 g/lance. O tal vez por la mayor profundidad que dificulta la captura.
En el periodo de aguas bajas, si bien la mayor abundancia se reporta para la quebrada de Sacanche, con 81.6 g/lance. Sin embargo, los otros tres valores mayores que siguen corresponden a ambientes acuáticos lénticos intervenidos, Sauce, San Pablo y Mashuyacu, con 76.9, 49.4 y 47.0 g/lance, respectivamente; repitiéndose el cuadro de aguas altas.
Aún considerando, que promediar los valores de abundancia calculados tiene poco sentido; sólo con fines comparativos, se obtuvo los valores correspondientes a aguas altas y bajas, de 24.4 y 26.9 g/lance, respectivamente, observándose poca diferencia; a despecho de lo esperado de que la abundancia en vaciante sería mucho mayor. Esta situación se explicaría por dos razones: (i) la alta transparencia de las aguas permite a los peces visualizar el arte de pesca y fugar del mismo, y (ii) la concentración de los peces no es tan diferente en ambos periodos hidrológicos, al no existir grandes áreas de inundación, como acontece en el llano amazónico.
Tabla 5.11 Cálculo del índice de abundancia de ambientes acuáticos muestreados.
| Ambiente muestreado |
Biomasa (g)
|
Nº lances
|
Abundancia |
|||
|
I
|
II
|
I
|
II
|
I
|
II
|
|
| 1. Huallaga 1 |
801
|
892.3
|
34
|
36
|
23.6
|
24.8
|
| 2. Huallaga 2 |
393
|
605
|
21
|
20
|
17.1
|
30.3
|
| 3. Huallaga 3 |
214
|
712
|
10
|
31
|
21.4
|
22.9
|
| 4. Caño Ajo |
819
|
378.8
|
30
|
10
|
27.2
|
37.9
|
| 5. Río Saposoa |
199
|
227.9
|
10
|
5
|
19.9
|
45.6
|
| 6. Qda. Sacanche |
225
|
815.7
|
10
|
10
|
22.5
|
81.6
|
| 7. Río Sisa medio |
435
|
483.1
|
20
|
21
|
21.8
|
23
|
| 8. Represa San Pablo |
45
|
493.5
|
10
|
10
|
4.5
|
49.4
|
| 9. Río Sisa bajo |
504
|
256.5
|
20
|
11
|
25.2
|
23.3
|
| 10. Sisa Tributarios |
1,019
|
202.2
|
16
|
9
|
63.7
|
22.5
|
| 11. Qda. Mishquiyacu |
109
|
52.7
|
20
|
10
|
5.4
|
5.3
|
| 12. Laguna Sauce |
448
|
2,307
|
53
|
30
|
8.5
|
76.9
|
| 13. Río Alto Mayo |
304
|
375.2
|
14
|
20
|
21.6
|
18.8
|
| 14. Río Tónchima |
8
|
118.8
|
4
|
11
|
2
|
10.8
|
| 15. Embalse Mashuyacu |
335
|
470.3
|
6
|
10
|
55.8
|
47
|
| 16. Río Indoche |
92
|
124.3
|
7
|
12
|
13.1
|
10.4
|
| 17. Represa del Gera |
475
|
159
|
6
|
10
|
79.2
|
15.9
|
| 18. Boca río Gera |
231
|
23.6
|
8
|
10
|
28.9
|
2.4
|
| 19. Cumbaza San Antonio |
34
|
47
|
10
|
8
|
3.4
|
5.9
|
| 20. Cumbaza Juan Guerra |
184
|
272.2
|
20
|
20
|
9.2
|
13.6
|
| 21. Qda. Ahuashiyacu |
366
|
798.6
|
20
|
22
|
18.3
|
36.3
|
| 22. Qda. Pucayacu |
345
|
313
|
10
|
15
|
34.5
|
20.9
|
| 23. Río Shanusi |
151
|
|
10
|
|
15.1
|
|
| 24. Qda. Yuracyacu |
426
|
|
10
|
|
42.6
|
|
| 25. Río Huallabamba |
|
97.2
|
|
4
|
|
24.3
|
| 26. Laguna Limón |
|
171.2
|
|
10
|
|
17.1
|
| 27. Río Bajo Mayo |
|
375.2
|
|
10
|
|
6.5
|
5.2.1.4. -Régimen alimenticio de las especies más frecuentes
De acuerdo al análisis del contenido estomacal de 19 y 17 especies más frecuentes, para aguas altas y bajas, respectivamente, se ha encontrado que los microorganismos predominan como ítem alimentario, llegando a 46.7 y 45% para sendos periodos. Los restos de insectos y de vegetales, alcanzan valores significativos de 31.2 y 18.5%, respectivamente, para aguas altas. Esto se debería a la mayor disponibilidad de la vegetación ribereña que se inunda, lo que condiciona a una mayor oferta de insectos que se asocian a aquella. Por el contrario, en aguas bajas, el porcentaje de detritus, se incrementa a 28.7%, en desmedro de los restos de insectos y de vegetales (Tabla 5.12).
Tabla 5.12. Composición relativa de ítem alimentarios de especies más frecuentes en la cuenca del HUALLAGA.
| Especies |
Porcentaje de Item alimentarios
|
|||||||||||
|
Microorganismos
|
Restos vegetales
|
Restos de insectos
|
Detritus
|
Arena
|
Tipo
|
|||||||
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
|
| Oreochromis niloticus |
94.3
|
93
|
5.7
|
0.9
|
0
|
0
|
0
|
6.1
|
0
|
0
|
M
|
M
|
| Poecilia reticulata |
84.3
|
39.4
|
14.4
|
6.8
|
1.2
|
0
|
0
|
39.3
|
0
|
14.5
|
M
|
D
|
| Astyanax sp |
95
|
90.8
|
0
|
1.1
|
0
|
1.1
|
5
|
7
|
0
|
0
|
M
|
M
|
| Knodus sp |
60.3
|
80.1
|
12.3
|
4.9
|
25.9
|
1.2
|
12.5
|
13.7
|
0.5
|
0
|
M
|
M
|
| Creagrutus sp |
29.1
|
6,5
|
58.2
|
38.7
|
3.6
|
2.4
|
9.1
|
48.4
|
0
|
4
|
H
|
O
|
| Galeocharax gulo |
20.8
|
0
|
0
|
43
|
79.2
|
0
|
0
|
57
|
0
|
0
|
I
|
D
|
| Bryconamericus sp |
57.5
|
68.4
|
9.6
|
3.8
|
26
|
2.2
|
6.7
|
18.3
|
0
|
7.3
|
M
|
M
|
| Cheirodon sp |
52.4
|
81.9
|
12.5
|
2
|
35.2
|
0
|
0
|
11.9
|
0
|
4.2
|
M
|
M
|
| Tatia sp |
18.4
|
|
1.5
|
|
80.1
|
|
0
|
|
0
|
|
I
|
|
| Paragoniates alburnus |
27.5
|
0
|
4.8
|
7.7
|
66.1
|
27
|
1.6
|
44.2
|
0
|
21.1
|
I
|
D
|
| Oloshestes sp |
0
|
|
76.9
|
|
23.1
|
|
0
|
|
0
|
|
H
|
|
| Hypostomus sp |
70.1
|
|
10
|
|
10
|
|
0
|
|
5
|
|
M
|
|
| Cichlasoma sp |
56.8
|
|
20.3
|
|
21.6
|
|
0
|
|
1.4
|
|
M
|
|
| Bujurquina huallagae |
58.2
|
39.2
|
24.5
|
8.7
|
12.2
|
0
|
6.1
|
15.2
|
0
|
36.9
|
M
|
M
|
| Scophaeocharax rinodus |
12.4
|
|
32
|
|
28
|
|
0
|
|
28
|
|
O
|
|
| Ctenobrycon sp |
22
|
|
0
|
|
78
|
|
0
|
|
0
|
|
I
|
|
| Aphiocharax sp |
0
|
3.2
|
11.5
|
0
|
88.5
|
0
|
0
|
83.9
|
0
|
0
|
I
|
D
|
| Ceratobranchia sp |
35.4
|
|
50
|
|
14.6
|
|
0
|
|
0
|
|
H
|
|
| Steindachnerina sp |
92
|
74.3
|
8
|
0
|
0
|
0
|
0
|
7.3
|
0
|
18.4
|
M
|
M
|
| Cichla monoculus |
|
90.8
|
|
1.1
|
|
1.1
|
|
7
|
|
0
|
|
M
|
| Scopaeocharax sp |
|
33.3
|
|
0
|
|
0
|
|
33.3
|
|
33.3
|
|
D
|
| Serrasalmus sp |
|
0
|
|
0
|
|
19.6
|
|
46.4
|
|
34
|
|
D
|
| Prionobrama sp |
|
10
|
|
16.7
|
|
46.7
|
|
13.3
|
|
13.3
|
|
I
|
| Moenkhausia sp |
|
53.4
|
|
3.4
|
|
1.3
|
|
35.8
|
|
6.1
|
|
M
|
Leyenda: M: micrófago; H: herbívoro; I: insectívoro; D: detritívoro; O: omnívoro
Sobre la base de lo anterior, se aproxima una tipificación de las especies más frecuentes (tabla 5.13), lo cual obviamente responde a la oferta de alimentos del ambiente donde se desarrollan, que a su vez varía de acuerdo a las condiciones ambientales, siendo el régimen de crecida de los ríos un factor determinante. Se han juntado a los fito y zooplanctófagos en la categoría de micrófagos, visto que se trata de peces filtradores. En el grupo de los omnívoros se han ubicado a aquéllos que no presentan una tendencia saltante en cuanto a su preferencia por un determinado ítem alimentario.
Gran parte de las especies, particularmente las micrófagas, conservan el mismo régimen alimentario a través del año, aun cuando disminuye el porcentaje del ítem que las tipifica, así por ejemplo en Poecilia reticulata los microorganismos representan el 39.4%, alternando con detritus con el 39.3%. Igual sucede con Bujurquina huallagae.
Creagrutus sp, que en el periodo de agua altas ha sido tipificada como herbívoro, con alternancia a micrófago, en aguas bajas cambia a detritívoro, con alternancia a herbívoro.
Los insectívoros de aguas altas: Galeocharax gulu, Paragoniates alburnus y Aphyocharax sp, en el periodo contrastante cambian a detritívoros, alternando con restos vegetales, y con microorganismos, las dos primeras especies, respectivamente; en tanto que la tercera fue eminentemente detritívora.
El "tucunaré" Cichla monoculus, pez eminentemente carnívoro, se reporta como micrófago; lo que se debería a que se trata de estadíos tempranos (10 a 15 g de peso), mientras que como adulto llega aproximadamente a los 2 a 3 kg. Otro caso particular se observa con Serrasalmus sp, que se reporta como detritívoro, siendo que es conocido como carnívoro, al igual que todos sus congéneres, se incluye dentro de la "pirañas"; se trataría, posiblemente, de una defectuosa identificación de los componentes del contenido estomacal por un avanzado estado de digestión.
Tabla 5.13. Tipificación trófica de las especies más frecuentes.
| ,Nivel tráfico |
Especie
|
|
|
I fase
|
II fase
|
|
| MICROFAGO | Oreocromis niloticus Poecilia reticulata Astyanax sp Knodus sp Bryconamericus sp Cheirodon sp Hypostomus sp Cichlassoma sp Bujurquina Huallagae Steidachnerina sp |
Oreocromis niloticus Poecilia reticulataAstyanax sp Knodus sp Bryconamericus sp Cheirodon sp Bujurquina huallagae Steidachnerina sp Cichla monoculus Moenkhausia sp |
| HERBIVORO | Creagrutus sp Holoshestes sp Scophaeocharax rinodus Ceratobranchia sp |
|
| INSECTIVORO | Galeocharax guloTatia sp Paragoniates alburnus Ctenobrycon sp Aphyocharax sp |
Prionobrama sp |
| DETRITIVORO | Creagrutus sp Galeocharax gulu Paragoniates alburnus Aphyocharax sp Serrasalmus sp |
|
| OMNIVORO | Creagrutus sp Scophaeocharax sp |
|
5.2.2.- OFERTA ALIMENTARIa
La presencia y la abundancia de ciertos grupos de organismos en determinados ambientes y su distribución depende de factores fisicoquímicos y biológicos, los cuales son los responsables por la presencia o ausencia de una especie dentro de un ambiente (Hardy 1978); así como, de su abundancia o escasez. En ese sentido, se presenta gran variación de los componentes de la oferta alimentaria en los cuerpos de agua muestreados, que para el caso se ha considerado sólo al material orgánico que se encuentra en suspensión.
La composición global de la oferta alimentaria, privilegia al fitoplancton, particularmente en aguas altas en que llega al 65%, que junto con el zooplancton alcanzan el 87% (plancton en general), con referencia a los demás componentes que sólo alcanzan el 13% (figura 5.2). Si bien esta composición se esperaba, pero, debe resaltarse el aporte de la laguna Sauce que alcanza el 27% (tabla 5.14), en el cómputo global. Los ambientes lóticos, por el contrario, presentan una escasa oferta de plancton.
En el periodo de aguas bajas, el cuadro es diferente, los componentes plancton y detritus están en el mismo nivel con 31.5% cada uno, seguidos por vegetales superiores y arena, con 21 y 15%, respectivamente; en tanto que los insectos sólo llegó al 1%.
Figura 5.2. Composición porcentual de la oferta alimentaria en los cuerpos de agua muestreados.
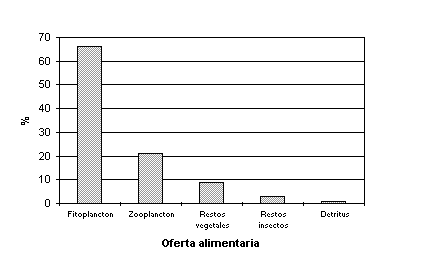
Tabla 5.14. Oferta alimentaria de los ambientes acuáticos muestreados en el área de estudio.
| Estación |
Fitoplancton
|
Zooplancton
|
Rest.insect.
|
Rest.veget.
|
Detritus
|
Arena
|
||||||
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
|
| 1. Huallaga 1 |
22
|
54
|
11
|
1
|
1
|
0
|
3
|
127
|
0
|
189
|
-
|
47
|
| 2. Huallaga 2 |
12
|
-
|
5
|
-
|
1
|
-
|
2
|
-
|
0
|
-
|
-
|
-
|
| 3. Huallaga 3 |
7
|
-
|
3
|
-
|
2
|
-
|
0
|
-
|
0
|
-
|
-
|
-
|
| 4. Caño Ajo |
3
|
4
|
6
|
32
|
0
|
0
|
7
|
30
|
0
|
21
|
-
|
12
|
| 5. Río Saposoa |
31
|
-
|
8
|
-
|
1
|
-
|
1
|
-
|
0
|
-
|
-
|
-
|
| 6. Qda. Sacanche |
17
|
2
|
21
|
10
|
14
|
0
|
0
|
17
|
2
|
58
|
-
|
14
|
| 7. Río Sisa Medio |
14
|
20
|
9
|
7
|
0
|
0
|
9
|
19
|
0
|
20
|
-
|
11
|
| 8. Represa San Pablo |
6
|
10
|
2
|
0
|
0
|
0
|
1
|
0
|
0
|
88
|
-
|
19
|
| 9. Sisa bajo |
10
|
-
|
8
|
-
|
0
|
-
|
6
|
-
|
0
|
-
|
-
|
-
|
| 10. Sisa tributarios |
24
|
19
|
8
|
21
|
1
|
0
|
3
|
14
|
0
|
7
|
-
|
4
|
| 11. Mishquiyacu |
61
|
34
|
11
|
7
|
0
|
0
|
2
|
21
|
0
|
18
|
-
|
29
|
| 12. Laguna Sauce |
179
|
163
|
21
|
4
|
2
|
0
|
14
|
0
|
5
|
0
|
-
|
1
|
| 13. Río alto Mayo |
8
|
56
|
4
|
5
|
0
|
11
|
2
|
29
|
0
|
60
|
-
|
48
|
| 14. Río Tónchima |
3
|
14
|
3
|
1
|
0
|
0
|
1
|
20
|
0
|
24
|
-
|
23
|
| 15. Represa Mashuyacu |
5
|
151
|
1
|
15
|
0
|
1
|
1
|
19
|
0
|
8
|
-
|
8
|
| 16. Río Indoche |
3
|
51
|
3
|
0
|
0
|
0
|
1
|
22
|
0
|
38
|
-
|
15
|
| 17. Represa del Gera |
2
|
4
|
1
|
3
|
0
|
2
|
1
|
18
|
0
|
13
|
-
|
7
|
| 18. Río Gera |
4
|
16
|
2
|
0
|
0
|
5
|
1
|
15
|
0
|
29
|
-
|
8
|
| 19. Río Cumbaza-S.Anton |
4
|
4
|
7
|
0
|
0
|
0
|
0
|
11
|
0
|
0
|
-
|
8
|
| 20. Río Cumbaza-J.Guerra |
5
|
2
|
4
|
9
|
0
|
5
|
3
|
18
|
0
|
0
|
-
|
19
|
| 21. Río Ahuashiyacu |
2
|
6
|
2
|
0
|
0
|
0
|
0
|
7
|
0
|
30
|
-
|
8
|
| 22. Pucayacu |
6
|
3
|
4
|
0
|
0
|
0
|
2
|
0
|
0
|
3
|
-
|
0
|
| 23. Río Shanusi |
5
|
-
|
4
|
-
|
0
|
-
|
3
|
-
|
0
|
-
|
-
|
-
|
| 24. Yuracyacu |
7
|
-
|
4
|
-
|
0
|
-
|
1
|
-
|
0
|
-
|
-
|
-
|
| 25. Huayabamba |
11
|
4
|
1
|
0
|
0
|
0
|
0
|
34
|
0
|
13
|
-
|
21
|
| 26. Laguna limón |
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
| 27. Río bajo Mayo |
-
|
11
|
-
|
0
|
0
|
0
|
-
|
17
|
-
|
39
|
-
|
8
|
El análisis de la ocurrencia de los componentes de la oferta alimentaria en cada cuerpo de agua muestreado no tendría mucho sentido, en la medida que un solo elemento encontrado puede ubicar en un mismo nivel que aquel ambiente que cuenta con una abundancia de un componente particular.
La información que se presenta en la tabla 5.15, permite establecer las comunidades ícticas, ubicando, globalmente, a los micrófagos en la base de la pirámide, con el 76.6% en el periodo de aguas altas y 78.5% en el periodo de vaciante. Los otros componentes de la cadena trófica siguen la distribución típica, ubicando a los pocos carnívoros en la cúspide de la pirámide. Sin embargo, en el periodo de vaciante los comedores de detritus alcanzan un alto nivel, llegando al 20%; lo que se relaciona favorablemente con la elevada oferta de detritus, que globalmente llega al 31.5%. Ambientes lénticos como San Pablo y Mashuyacu, ubica a los detritívoros en la base de la pirámide trófica, con el 95 y 94%, respectivamente. Otros ambientes lóticos como Cumbaza San Antonio y Sisa tributarios, también, presentan más del 50% de detritívoros y, en este caso no está asociado a una mayor magnitud de este componente de la oferta alimentaria.
Finalmente, las comunidades ícticas constituyen componentes de la oferta alimentaria para los peces piscívoros, a los cuales no estaba dirigido el muestreo.
Tabla 5.15 Porcentaje de individuos y número de especies por nivel trófico en los ambientes acuáticos muestreados.
| Ambiente muestreado |
Número de ejemplares y especies por
nivel trófico
|
|||||||||||||||||||||||
|
Micrófagos
|
Insectívoros
|
Herbívoros
|
Omnívoros
|
Carnívoros
|
Detritívoros
|
|||||||||||||||||||
|
%
|
Esp
|
%
|
Esp
|
%
|
Esp
|
%
|
Esp
|
%
|
Esp
|
%
|
Espec.
|
|||||||||||||
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
I
|
II
|
|
| 1. Huallaga 1 |
93.2
|
99.2
|
7
|
8
|
4.5
|
0.7
|
5
|
2
|
21.1
|
|
2
|
|
0
|
0
|
0
|
1
|
0.2
|
|
1
|
|
|
0.1
|
|
1
|
| 2. Huallaga 2 |
70.3
|
99.7
|
4
|
7
|
25.6
|
0
|
3
|
0
|
4.1
|
|
1
|
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
|
0.1
|
|
1
|
| 3. Huallaga 3 |
0
|
83.1
|
0
|
11
|
8.5
|
4.2
|
2
|
1
|
0
|
|
0
|
|
91.5
|
0.2
|
3
|
0
|
0
|
|
0
|
|
|
12.5
|
|
4
|
| 4. Caño Ajo |
82.5
|
55
|
8
|
7
|
13.3
|
0
|
3
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
1.7
|
|
3
|
|
|
45
|
|
4
|
| 5. Río Saposoa |
94.1
|
96.9
|
5
|
3
|
4.1
|
0
|
5
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
1
|
1.8
|
|
4
|
|
|
3.1
|
|
2
|
| 6. Qda. Sacanche |
79.7
|
99.2
|
6
|
5
|
18.9
|
0
|
3
|
0
|
0.5
|
|
1
|
|
0
|
0
|
0
|
0
|
0.9
|
|
2
|
|
|
0.8
|
|
5
|
| 7. Río Sisa medio |
76.8
|
55.7
|
9
|
6
|
19.2
|
0
|
4
|
0
|
1.7
|
|
1
|
|
0
|
1
|
0
|
0
|
2.3
|
|
2
|
|
|
43.3
|
|
3
|
| 8. Represa San Pablo |
73
|
5
|
4
|
6
|
25.2
|
0
|
2
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
1.7
|
|
1
|
|
|
95
|
|
3
|
| 9. Río Sisa Bajo |
91.4
|
92.8
|
5
|
6
|
4.7
|
0
|
3
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
3.9
|
|
2
|
|
|
7.2
|
|
4
|
| 10. Sisa tributarios |
70.6
|
45.2
|
9
|
2
|
24.6
|
0
|
2
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
4.8
|
|
3
|
|
|
54.8
|
|
1
|
| 11. Qda. Mishquiyacu |
54.6
|
85.9
|
4
|
3
|
9.6
|
0
|
2
|
0
|
3
|
|
2
|
|
38.8
|
0
|
3
|
1
|
0
|
|
0
|
|
|
14.1
|
|
3
|
| 12 Laguna Sauce |
100
|
77.9
|
6
|
6
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
|
22.1
|
|
1
|
| 13. Río Alto Mayo |
61.3
|
56.7
|
4
|
2
|
0
|
0
|
0
|
0
|
38.7
|
|
|
|
0
|
17.9
|
0
|
0
|
0
|
|
0
|
|
|
25.4
|
|
1
|
| 14. Río Tónchima |
87.5
|
100
|
2
|
4
|
0
|
0
|
0
|
0
|
12.5
|
|
1
|
|
0
|
0
|
0
|
1
|
0
|
|
0
|
|
|
0
|
|
0
|
| 15. Embalse Mashuyacu |
100
|
6
|
4
|
3
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
|
94
|
|
1
|
| 16. Río Indoche |
41.9
|
92.8
|
4
|
1
|
0
|
0
|
0
|
0
|
58.1
|
|
1
|
|
0
|
4.3
|
0
|
0
|
0
|
|
0
|
|
|
2.9
|
|
1
|
| 17. Represa del Gera |
100
|
90
|
2
|
2
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
1
|
0
|
|
0
|
|
|
10
|
|
1
|
| 18. Boca del río Gera |
80
|
100
|
3
|
3
|
4.5
|
0
|
2
|
0
|
15.5
|
|
2
|
|
0
|
0
|
0
|
0
|
0
|
|
0
|
|
|
0
|
|
0
|
| 19. Cumbaza San Antonio |
79.6
|
38.3
|
2
|
8
|
0
|
0
|
0
|
0
|
2
|
|
1
|
|
18.4
|
2.9
|
1
|
1
|
0
|
|
0
|
|
|
58.8
|
|
1
|
| 20. Cumbaza J. Guerra |
91.6
|
100
|
7
|
7
|
6.5
|
0
|
23
|
0
|
0
|
|
0
|
|
0
|
0
|
0
|
1
|
1.9
|
|
1
|
|
|
0
|
|
0
|
| 21. Qda. Ahuashiyacu |
60.1
|
95.5
|
9
|
7
|
19
|
0
|
1
|
0
|
9.8
|
|
2
|
|
8.6
|
3.8
|
1
|
|
2.5
|
|
2
|
|
|
0.7
|
|
2
|
| 22. Qda. Pucayacu |
80.5
|
97.5
|
6
|
|
18.1
|
0
|
1
|
0
|
0
|
|
0
|
|
0
|
0.6
|
0
|
|
1.4
|
|
1
|
|
|
1.9
|
|
3
|
| 23. Río Shanusi |
96.9
|
|
2
|
|
3.1
|
|
3
|
|
0
|
|
0
|
|
0
|
|
0
|
0
|
0
|
|
0
|
|
|
|
|
|
| 24. Qda. Yuracyacu |
73.3
|
|
4
|
|
4.1
|
|
|
|
21.2
|
|
2
|
|
0
|
|
0
|
0
|
1.4
|
|
2
|
|
|
|
|
|
| 25.Río Huallabamba |
|
90.7
|
|
3
|
|
0
|
|
0
|
|
|
|
|
|
0
|
|
0
|
|
|
|
|
|
9.3
|
|
1
|
| 26. Laguna Limón |
|
98.7
|
|
1
|
|
0
|
|
0
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
1.1
|
|
1
|
| 27. Río bajo Mayo |
|
100
|
|
2
|
|
0
|
|
0
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
0
|
|
0
|
1 Esta sección está basada en la sistematización de información secundaria (reportes de la Dirección Regional de Pesquería de San Martín, los resultados de los Censos de Población y Vivienda de 1972, 1981 y 1993, el Directorio de Centros Poblados del Instituto Nacional de Estadística e Informática INEI , los resultados del Censo Agropecuario, etc.) e información de campo recopilada utilizando la técnica y pautas metodológicas del Diagnóstico Rural Rápido (DRR), así como los resultados de la encuesta aplicada a 72 piscicultores en el mes de octubre de 1998.
2 En 1993, el 32.2% de la población total del área de estudio estaba conformada por inmigrantes de otras regiones. Las zonas y/o regiones de procedencia de la población inmigrante está conformado principalmente por los departamentos de Cajamarca, Amazonas, Piura, Loreto, Lima y la Libertad. De estois seis (06) departamentos proviene el 80% de la población migrante.
3 En base a esta información estadística disponible, la población económicamente activa PEA de la Región San Martin se estima en 295,117 personas, y el producto bruto interno regional en cerca de mil millones de dólares anuales (2% del PBI nacional)
4 Numeral 6.2.4.
5 según reportes de la Dirección Regional de Pesqueria de San Martin, en 1979 existían apenas 84 granjas acuícolas con una producción anual de 10.5 toneladas. Para el presente año, se estima 921 establecimientos acuícolas con una producción superior a 760 toneladas anuales, de los cuales cerca del 48% está representado por la tilapia.
5.3 AMBIENTE SOCIOECONÓMICO
5.3.1.-POBLACION (tabla 5.16)
La población actual (1999) estimada del departamento de San Martín asciende a 740,447 habitantes, esto representa aproximadamente el 2.6% de la población nacional y 20% de la población de la Amazonía peruana. Esta población es en general de origen mestizo, con un alto componente de migrantes ( En 1993, el 32.2% de la población total del área de estudio estaba conformada por inmigrantes de otras regiones. Las zonas y/o regiones de procedencia de la población inmigrante está conformado principalmente por los departamentos de Cajamarca, Amazonas , Piura, Loreto, Lima y la Libertas. De estos seis (6)departamentos proviene el 80 % de ka población migrante) La población indígena, estimada en apenas 1,500 habitantes, está conformada, principalmente, por el grupo étnico Aguaruna, afincado en las partes altas de las cuencas de los ríos Mayo, Naranjillo y Huascayacu (INEI, 1993).
La población e infraestructura productiva de mayor
importancia están concentradas, espacialmente, en los valles formados
por los ríos Huallaga, Mayo y sus principales tributarios. Por ambos
valles recorre la Carretera Marginal de la Selva, uniendo las ciudades y poblados
urbanos más importantes de la Región.
El crecimiento poblacional en la zona de estudio, hasta la
década pasada, fue substantivamente mayor al del ámbito nacional.
Ello podría atribuirse al auge de la actividad de narcotráfico
y la implementación de los proyectos especiales de desarrollo, promovidos
por el gobierno en los primeros años de la década del 80. Las
tasas más altas de crecimiento poblacional se presentaron en las provincias
con alta incidencia de la actividad del narcotráfico, tales como: Tocache,
7.3%; Mariscal Cáceres, 6.1%; y Bellavista, 5.2%; y las ciudades de Tarapoto
y Moyobamba que en el período intercensal 1981-93, registraron tasas
de crecimiento del 5.7 y 4.6%, la tercera y cuarta más altas entre todas
las ciudades del país (Lesevic, 1984; Aramburú, 1984; INEI, 1981;
1993).
Tabla 5.16. Indicadores de población de la zona de estudio.
| 1.- POBLACION TOTAL (1999) |
740,447
|
| Población urbana |
60.81%
|
| Población rural |
39.19%
|
| 2.- COMPOSICION POR SEXO |
|
| Población Masculina |
53.30%
|
| Población Femenina |
46.70%
|
| 3.- DENSIDAD POBLACIONAL (hab/km2) |
14.4
|
| 4.- TASA DE CRECIMIENTO PROM. ANUAL (1981-1993) |
4.70%
|
| 5.- INDICE DE MASCULINIDAD |
107.9
|
| 6.- TASA DE FECUNDIDAD |
4.8
|
| 7.- NUMERO DE HIJOS POR MUJER |
2.8
|
| 8.- POB. CON NECESIDADES BASICAS INSATISFECHAS |
71.90%
|
| Area urbana |
60.60%
|
| Área rural |
87.60%
|
FUENTE: INEI 1993 y Fichas de Información Socioeconómica (enero 1998).
5.3.2. PRINCIPALES ACTIVIDADES ECONOMICAS
El departamento de San Martín, particularmente la parte sur, ha sido escenario del surgimiento simultáneo de las actividades del narcotráfico y terrorismo, las que se acentuaron a finales de la década pasada e inicios de la presente. Este hecho ha perturbado de manera significativa el desarrollo de muchas actividades económicas formales como la agricultura, la ganadería y la industria, para las que cuenta con potencialidades probadas (CTAR-SM, 1997).
A pesar de ello, en la década pasada e inicios de la presente, la economía del departamento de San Martín ha registrado un crecimiento sostenido, influenciado en parte por la implementación de los proyectos especiales de colonización como son: el Proyecto Especial Alto Mayo (PEAM); el Proyecto Especial Huallaga Central y Bajo Mayo (PEHCBM); y, el Proyecto Especial Alto Huallaga (PEAH). Sin embargo, a pesar de este crecimiento sostenido, el aporte departamental a la producción nacional ha fluctuado apenas entre el 1.5 y 2%.
La principal actividad económica de la población es la agricultura, la que, paralelo a la disminución de los fenómenos de narcotráfico y terrorismo en los últimos años, ha mostrado una tendencia positiva. Esta actividad ocupa el 51.8% de la población económicamente activa PEA (152,870 personas) (figura 5.3), y contribuye con más del 30% del producto bruto interno -PBI- departamental (En base a la información estadística disponible, la población económicamente activa PEA de la Región San Martín se estima en 295,117 personas, y el producto bruto interno regional en cerca de mil millones de dólares anuales (2% del PBI nacional)) (figura 5.4) (BCR, 1997, CTAR-SM, 1997; INEI, 1994).
Otras actividades importantes después de la agricultura son: la prestación de servicios, el comercio y la industria manufacturera, que absorben alrededor del 15%, 10% y el 5.4% de la PEA, respectivamente. La construcción y la explotación de minas y canteras representan, individualmente, menos del 2% de aporte al producto interno y ocupación de la PEA.
La pesca (pesca artesanal y acuicultura) estaría empleando directamente alrededor de 1,500 personas (0.5% de la PEA regional, según estadísticas del INEI), de los cuales 700 corresponderían a la actividad acuícola y el resto al rubro de pesca artesanal (Numeral 6.2.4). Esta actividad, sobre todo en los niveles de subsistencia y de mediana escala, se practica marginalmente a la agricultura, por lo que pasa desapercibido. No obstante el aporte, aparentemente, reducido en la generación de empleo directo de esta actividad, en las últimas décadas ha mostrado una tendencia positiva como consecuencia de la implementación de granjas acuícolas dedicadas, principalmente, al cultivo de la tilapia(Según reportes de la Dirección Regional de Pesquería de San Martín, en 1979 existían apenas 84 granjas acuícolas con una producción anual de 10.5 toneladas. Para el presente año, se estima 921 establecimientos acuícolas con una producción superior a 760 toneladas anuales, de los cuales cerca del 48% está representado por la tilapia). (DIREPE, 1992 - 1997) .
Figura 5.3. Composición de la PEA según actividad económica (1992)
FUENTE: INEI, 1994
Figura 5.4 Composición del PBI según ramas de actividad económica (1992)
FUENTE: INEI, 1994
5.3.3.- LA ACTIVIDAD ACUICOLA
La acuicultura en la Región se practica, principalmente, a nivel familiar y como una actividad complementaria a la agricultura. En la mayoría de los casos, se aprovecha la infraestructura de riego.
A la fecha se estima la existencia de 506 piscigranjas operativas, de un total de 921. Según los resultados de la encuesta a piscicultores, en 1998 se ha producido alrededor de 766 toneladas de pescado en establecimientos acuícolas (con un rendimiento promedio de 2.4 t/ha/año), lo que constituye un valor total de 4´918, 167 Nuevos Soles, equivalente a US $ 1´446,637.
Tabla 5.17 Volúmenes de producción según especies
| Especie |
Producción promedio piscicultor/campaña(Kg.)
|
Prom. de campañas
por año
|
Produc. Prom.Piscicultor/año
(kg.)
|
Producción total por
año (t)
|
| Tilapia |
572.78
|
1.27
|
724.92
|
367.21
|
| Carpa |
158.61
|
1.56
|
246.73
|
124.98
|
| Camarón |
145.14
|
1.33
|
193.52
|
100.26
|
| Boquichico |
15.56
|
1
|
15.56
|
98.03
|
| Gamitana |
268.61
|
0.74
|
197.92
|
46.94
|
| Paco |
27.78
|
1.5
|
41.67
|
21.11
|
| Otras especies |
82.36
|
1.13
|
92.66
|
7.88
|
| TOTAL |
1,270.83
|
|
1,512.97
|
766.4
|
FUENTE: Encuesta a piscicultores
A nivel de los acuicultores, existe una alta variabilidad en los volúmenes de producción como en la infraestructura instalada. En el primer caso, varía desde 20 hasta 8,000 kg por campaña; y, en el segundo, desde 80 m2 hasta 6 hectáreas.
Ninguno de los acuicultores encuestados cubre sus ingresos familiares exclusivamente con la actividad acuícola. En promedio, la acuicultura representa aproximadamente el 28% de sus ingresos. Ninguno de los acuicultores encuestados cubre sus ingresos familiares exclusivamente con la actividad acuícola. En promedio, la acuicultura representa aproximadamente el 28% de sus ingresos familiares, pues, el resto proviene de otras actividades como la agricultura, ganadería u otros.
Tanto la encuesta aplicada como los reportes de la Dirección Regional de Pesquería, evidencian que la especie más difundida es la Tilapia, que llega a representar el 48% del volumen de producción y es cultivada por el 80% de los acuicultores. Otras especies como la carpa, camarón y boquichico representan, respectivamente, el 16.3%, 13.1% y 12.8% de la producción acuícola (Tabla 5.17).
Respecto al destino de la producción, en promedio, el 87.8% se destina a la venta, y el 12.2% al autoconsumo (Tabla 5.18). No obstante ello, el 46.5% de los acuicultores realiza esta actividad de manera muy marginal y los destina exclusivamente al autoconsumo. Las especies cultivadas con fines más comerciales son el camarón, la gamitana y el paco que son destinados al mercado en porcentajes del 98.3%, 97.4% y 96.2%, respectivamente.
Tabla 5.18 Destino
de producción acuícola según especies cultivadas
|
Especie
|
PRODUCCION
|
VENTA
|
AUTOCONSUMO
|
| · TILAPIA |
367.21
|
80.20%
|
19.80%
|
| · CARPA |
124.98
|
85.70%
|
14.30%
|
| · CAMARON |
100.26
|
98.30%
|
1.70%
|
| · BOQUICHICO |
98.03
|
89.30%
|
10.70%
|
| · GAMITANA |
46.94
|
97.40%
|
2.60%
|
| · PACO |
21.11
|
96.00%
|
4.00%
|
| · OTRAS ESPECIES |
7.88
|
92.20%
|
7.80%
|
| TOTAL |
766.4
|
87.80%
|
12.20%
|
FUENTE: Encuesta a Piscicultores
5.3.4.- PRINCIPALES MERCADOS Y ABASTECIMIENTO DE PRODUCTOS PESQUEROS
Los mercados internos de la región San Martín están conformados por las principales ciudades como: Tarapoto, Moyobamba, Juanjui, Tocache, y, Rioja. Gran parte de la producción interna agrícola y toda la producción en otros sectores es para abastecer el mercado regional. Los únicos productos orientados al mercado extra regional son el arroz, el café, el té, y algunas especies frutales, especialmente cítricas que son llevadas hacia Iquitos.
El departamento de San Martín, con más 740 mil habitantes, es un mercado bastante amplio para la comercialización de productos hidrobiólógicos provenientes de otras regiones, pues la producción interna representa menos de 5% del volumen comercializado en la región, cubriéndose la diferencia con productos de procedencia continental (85.8%) provenientes de Iquitos, Yurimaguas, Pucallpa y Sullana/Piura, y, productos de procedencia marítima (9.6%) (fig. 5.5)
Los mercados más importantes para los productos acuícolas de la región son: Tarapoto, Moyobamba y Rioja, cuyos pobladores han incorporado a las especies exóticas (principalmente, la tilapia y carpa) en su dieta de consumo alimentario. Según los resultados de la encuesta, anualmente se comercializan alrededor de 672 toneladas de pescado proveniente de la actividad acuícola, de los cuales las estadísticas de la DIREPE de San Martín estaría registrando apenas cerca del 15.7%.
Figura 5.5 Productos hidrobiológicas comercializadas en el departamento San Martín según procedencia.
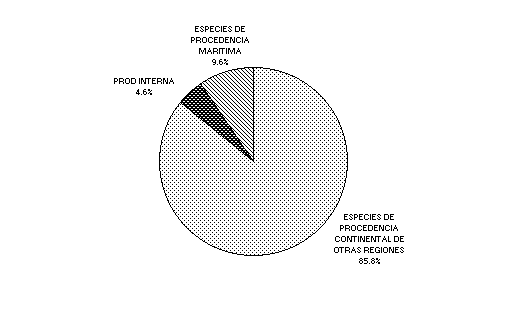
FUENTE: DIREPE San Martín, 1997.
