

Tema IV: TRABAJOS DEL CENTRO DE REPRODUCCION Y CONSERVACION DE PRIMATES (EN CAUTIVERIO)
OBSERVACIONES DE LA ALIMENTACION EN PAREJAS
DE Saguinus mystax
MANTENIDAS EN LA ESTACION DEL PROYECTO PRIMATES (AMRO 3171), IQUITOS, PERU
Hilary 0. Box y Joan M. Morris
INTRODUCCIÓN
Se diseñó un estudio para examinar dos aspectos de importancia en relación a la salud general y reproducción de Saguinus mystax en cautiverio:
1. ¿Existe evidencia de una competición entre las parejas sobre algunos tipos de alimentos?
2. ¿Hay preferencias por ciertos tipos de alimentos, y hay otros (posiblemente de mayor valor nutritivo) que son relativamente menos preferidos?
MÉTODOS
Dos observadores estudiaron 33 parejas de S. mystax durante el mes de Abril de 1978. Se juzgaba que, para un estudio preliminar, 33 parejas representaban una muestra adecuada de la colonia total de parejas mantenidas en el Centro de Reproducción y Conservación de Primates No Humanos de Iquitos (CRCP). Cada pareja fue observada por una sesión diaria de 30 minutos, inmediatamente después del suministro de la primera ración diaria de comida. En un galpón, la comida se administró a las 11:00 de la manada y en otro a las 11:30; lo que permitió observar 2 parejas por día. El estudio fue organizado, procurando no causar mayores disturbios en la rutina diaria del mantenimiento de los galpones.
Se tomaron datos cuantitativos de la alimentación, observando a los dos miembros de la pareja simultáneamente y anotando los alimentos que consumieron, y el tiempo y el orden en que los consumían. Dividimos cada sesión de 30 minutos en 90 períodos de 20 segundos. Estos períodos de registro fueron establecidos en base a nuestras observaciones preliminares de las parejas, pues eran apropiados para resaltar las cantidades relativas de consumo de los diferentes tipos de alimento, y permitían registros de buena confiabilidad. El período de 30 minutos de observación fue así mismo establecido en base a nuestras observaciones previas, porque después de los 30 minutos la mayoría de los animales dejaban de comer e iniciaban otras actividades, tales como descanso y/o despioje.
Los resultados fueron computados contando para cada mono, el número total de períodos de 20 segundos en que comió determinado tipo de alimento. Los Cuadros 1, 2, 3 y 4 muestran los resultados.
Nota sobre el diseño general del estudio
Anotamos todos los tipos de alimento que se les suministraba a los monos durante el período de estudio. Sin embargo, el tipo de alimento y el número de diferentes tipos de alimento que se les suministraba diariamente no fueron controlados mediante un diseño previo, por lo que el término "preferencias de alimentos" tiene que ser aplicado en un sentido bastante restringido. Asimismo, la presencia o ausencia de agua durante las 2 horas que precedieron a las sesiones de observación dependía de si se les administraba vitaminas o no; esto fue al comienzo del estudio. No obstante, a nuestro pedido, se les daba agua antes de empezar las observaciones. Un examen completo de las preferencias alimentarias, y de la posible competición, ocurriría obviamente durante todas las horas del día en que había comida disponible en las jaulas, pero esto no era práctico ni necesario. Sin embargo, era importante revisar al final de cada día la cantidad aproximada y el tipo de comida dejada por,cada pareja.
RESULTADOS
En general, no hubo indicios de competición dentro de las parejas por algún tipo particular de alimento. En los registros referentes a 17 parejas, hubo sólo 3 incidentes detectables de competición. En todos los casos, se trataba de suplantación de la hembra por el macho en la botella de agua, y no hubo casos de competición por la comida. En otro de los registros referentes a 16 parejas, también hubo 3 incidentes de competición entre la pareja. En todos los casos, se trataba de agresión por parte del macho hacia la hembra por comida, y no se observaron casos de competición por el agua en las parejas.
Por lo tanto, de nuestros datos podemos deducir lo siguiente: 1) No hubo competición dentro de las parejas por determinados tipos de alimento; 2) La incidencia general de competición abierta era baja (6 registros en un total de 180 períodos); 3) En todos los casos de competición abierta, los machos eran los dominantes.
Sin embargo, es obvio que la competición entre animales no está indicada solamente, ni usualmente por alguna forma de interacción agresiva. El hecho de que,uno de los animales no come, sino permanece sentado quieto, puede indicar la existencia de competición. Por eso, otra manera de examinar el aspecto de competición por los alimentos en nuestras parejas de S. mystax era examinando el tiempo de tardanza en empezar a comer. Los Cuadros 3 y 4 demuestran que en la mayoría de los casos ambos animales de la pareja comieron dentro del primer período de 20 s., después de la introducción de la comida. Hubo algunos casos contados en que la tardanza en empezar a comer fue mayor, siendo la máxima tardanza observada de 11 períodos de 20 s. Pero en ninguno de los 2 casos de mayor tardanza (uno de 10 y otro de 11 períodos) hubo otros indicios de competición que se reflejaran en problemas de salud o comportamiento. No obstante, hay varios casos en que los individuos pasaron un tiempo considerable sin comer o beber. En tales casos, nunca se les observó intentar de obtener comida y no poder hacerlo. Además, en tales circunstancias estaban generalmente descansando relajadamente o despiojando; así que, a pesar de que varios de los animales observados tenían el pelo muy ralo y la cola con llagas, tampoco es indicio de que tuvieran un acceso limitado a alguna comida. Por tanto, la suposición de que los animales no comían, por los aspectos señalados, parece insostenible.
Cuadro1.- Número total de períodos de 20 segundos en que individuos de S. mystax fueron observados consumir determinados tipos de alimentos. ,
| Hob | Egg | Banana | Bread | Yuca | Guaba | Corn | Shimbillo | Uvilla | Aguaje | Carrot | Caimoto | Gr Breans | Shimulla | Lettuce | Drink | Not Eating | Egg | Banana | Bread | Yuca | Guaba | Corn | Shimbillo | Uvilla | Aguaje | Carrot | Caimoto | Gr Breans | Shimulla | Lettuce | Drink | Not Eating | |
| (24)I | 0 | 2 | 0 | - | 68 | 13 | - | - | 0, | 0 | 0 | 0 | - | - | 4 | 4 | (24)I | 0 | 14 | 1 | - | 24 | 3 | - | - | 0 | 0 | 0 | 0 | - | - | 18 | 36 |
| (1)1 | 0 | 0 | 0 | - | 33 | - | 0 | - | - | - | - | 0 | - | - | 0 | 57 | (0)1 | 0 | 0 | 4 | - | 4 | - | - | - | - | - | - | 71 | - | - | 1 | 35 |
|
(5)1 |
0 | 5 | 0 | - | 30 | 13 | 0 | - | - | - | 0 | 0 | - | - | 2 |
41 |
(5)1 |
0 | 10 | 0 | - | 31 | 28 | 3 | - | - | - | - | 0 | - | - | 1 | 35 |
| (17)1 | 0 | 8 | 0 | - | 41 | 0 | 1 | - | - | 0 | 1 | 0 | - | 2 | 0 | 32 | (17)1 | 0 | 10 | 0 | - | 33 | 0 | 2 | - | - | - | 21 | 1 | - | 5 | 4 | 22 |
| (21)1 | - | 11 | 0 | - | 22 | 23 | - | - | - | - | - | - | - | - | 3 | 31 | (20)1 | - | 0 | 0 | - | 53 | 27 | - | - | - | - | - | - | - | - | 0 | 10 |
| (4)1 | 2 | 9 | 34 | - | 9 | 0 | - | - | - | - | - | - | - | - | 8 | 31 | (14)1 | 0 | 33 | 12 | - | 20 | 0 | - | - | - | - | - | - | - | - | 7 | 19 |
| (2)1 | - | 29 | 0 | - | 7 | 0 | - | 0 | - | 0 | - | 0 | - | - | 2 | 53 | (2)1 | - | 12 | 25 | - | 22 | 0 | - | 0 | - | 0 | - | 0 | - | - | 4 | 32 |
| (3)1 | 0 | 16 | 2 | - | 8 | 26 | - | 5 | - | 0 | - | 0 | - | - | 4 | 29 | (3)1 | 0 | 5 | 0 | - | 17 | 51 | - | 12 | - | - | - | 0 | - | - | 4 | 4 |
| (22)1 | - | 0 | 13 | - | - | 28 | - | - | - | - | - | - | 44 | - | 2 | 6 | (22)1 | - | 18 | 8 | - | - | 16 | - | - | - | - | - | - | 33 | - | 0 | 15 |
|
(12)11 |
0 |
19 |
0 |
- |
- |
0 |
0 |
- |
- |
- |
- |
0 |
- |
- |
34 |
37 |
(12)1 |
0 |
23 |
0 |
- | - | 0 | 0 | - | - | - | - |
0 |
- |
- |
24 |
46 |
| (15)1 | - | 5 | 0 | - | - | 0 | - | - | - | - | - | - | 20 | - | 0 | 65 | (19)1 | - | 16 | 2 | - | - | 0 | - | - | - | - | - | - | l6 | - | 8 | 5,0 |
| (6)11 | - | 8 | 0 | - | - | 22 | 0 | - | - | - | - | - | - | - | 8 | 53 | (6)1 | - | 38 | 0 | - | - | 0 | 1 | - | - | - | - | - | - | - | 5 | 46 |
| (23)11 | 0 | 8 | 16 | - | 6 | 0 | - | 3 | - | 0 | - | 0 | - | - | 17 | 44 | (23)11 | 0 | 6 | 10 | - | 1 0 | 0 | - | 20 | - | 0 | - | 0 | - | - | 12 | 34 |
| (20)11 | - | 2 | 0 | - | 19 | 0 | - | - | - | - | - | - | - | - | 12 | 61 | (20)11 | - | 28 | 0 | - | l4 | 0 | - | - | - | - | - | - | - | - | 0 | 48 |
| (26)11 | 11 | 10 | 0 | - | 9 | 0 | - | 23 | - | 23 | - | 0 | - | - | 4 | 11 | (26)11 | 0 | 21 | 0 | - | 21 | 0 | - | 1 | - | 0 | - | 0 | - | - | 5 | 36 |
| (21)11 | 0 | 4 | 5 | - | 19 | 0 | - | - | - | - | - | 0 | - | - | 0 | 63 | (20)11 | 0 | 28 | 0 | - | 0 | 1 | - | - | - | - | - | 2 | - | - | 10 | 51 |
| (13)11 | 0 | 11 | 0 | - | 37 | 0 | 0 |
- |
- | - | 0 | 0 | - | 0 | 0 | 43 | (13)11 | - | 1 | 11 | 0 | 1 | 0 | 0 | - | - | - | 0 | 0 | - | 0 | 0 | 65 |
Cuadro 2.- Número total de períodos de 20
segundos en que individuos de S. mystax fueron observados consumir determinados
tipos de alimentos*
| II | Egg | Banana | Bread | Yuca | Guaba | Corn | Shimbillo | Uvilla | Aguaje | Carrot | Caimoto | Gr Breans | Shimulla | Lettuce | Drink | Not Eating | Egg | Banana | Bread | Yuca | Guaba | Corn | Shimbillo | Uvilla | Aguaje | Carrot | Caimoto | Gr Breans | Shimulla | Lettuce | Drink | Not Eating | |
|
(33)1 |
Data not reliable |
(33)1 |
Data not reliable |
||||||||||||||||||||||||||||||
| (9)I | 0 | 5 | 8 | - | 31 | - | 4 | - | - | - | - | 0 | - | - | 0 | 45 | (19) | 0 | 7 | 11 | - | 28 | - | 0 | - | - | - | - | 0 | - | - | 0 | 44 |
| (7)I | 0 | 9 | 6 | - | 10 | 0 | 2 | - | - | - | 6 | 0 | - | - | 2, | 55 | (17)I | 0 | 0 | 0 | - | 34 | 0 | 3 | - | - | - | 12 | 1 | - | - | 0 | 40 |
| (20)I | 0 | 8 | 4 | - | 24 | 20 | 0 | - | - | 0 | 0 | 0 | - | 0 | 1 | 35 | (20) | 0 | 21 | 1 | - | 23 | 0 | 3 | - | - | 0 | 1 | 0 | 1 | 4 | 38 | |
| (9)I | - | 20 | 8 | - | 25 | 7 | - | - | - | - | - | - | - | - | 0 | 31 | (9)I | 0 | 9 | 12 | - | 21 | 0 | - | - | - | - | - | - | - | - | 0 | 49 |
| (10)I | 0 | 26 | 0 | - | 5 | 0 | - | - | - | - | - | - | - | - | 4 | 55 | (10)I | 0 | 9 | 0 | - | 14 | - | - | - | - | - | - | - | - | - | 2 | 66 |
|
(11)I |
- |
10 |
27 |
- |
10 |
0 |
- |
6 |
- |
0 |
- |
0 |
- |
- |
6 |
34 |
(11)I |
- |
6 |
38 |
- |
6 |
0 |
- |
2 |
- |
0 |
- |
- |
- |
- |
11 | 28 |
| (15)I | 0 | 13 | 0 | - | 6 | 24 | - | 17 | - | 0 | - | 0 | - | - | 5 | 27 | (15)I | 0 | 1 | 0 | - | 20 | 59 | - | 6 | - | 0 | - | 0 | - | - | 0 | 4 |
| (16)I | - | 0 | 5 | - | - | 0 | - | - | - | - | - | - | 69 | - | 0 | 16 | (6)I | 0 | 9 | 9 | - | - | 0 | - | - | - | - | - | - | 49 | - | 2 | 21 |
| (8)2II | 0 | 22 | 0 | - | - | 2 | 5 | - | - | - | - | 0 | - | - | 6 | 56 | (8)II | 0 | 7 | 1 | - | - | 22 | 0 | - | - | - | - | 0 | - | - | 5 | 56 |
| (28)II | - | 25 | 0 | - | - | 0 | - | - | - | - | - | - | 20 | - | 9 | 37 | (28)II | - | 4 | 11 | - | - | 0 | - | - | - | - | - | - | 30 | - | 11 | 36 |
| (22)II | - | 7 | 0 | - | - | 6 | 1 | - | - | - | - | - | - | - | 0 | 76 | (22)II | - | 12 | 0 | - | - | 16 | 7 | - | - | - | - | - | - | - | 2 | 53 |
| (3)II | 11 | 12 | 0 | - | 30 | 0 | - | 1 | - | 0 | - | 0 | - | - | 14 | 24 | (3)II | 4 | 9 | 3 | - | 0 | 0 | - | 16 | - | - | 0 | - | 0 | - | 18 | 42 |
| (15)II | - | 18 | 0 | - | 2 | 0 | - | - | - | - | - | - | - | - | 13 | 57 | (6)II | - | 15 | 0 | - | 25 | 0 | - | - | - | - | - | - | - | - | 9 | 42 |
| (10)II | 0 | 2 | 0 | - | 12 | 36 | - | 8 | - | 0 | - | 0 | - | - | 1 | 32 | (10)II | 0 | 16 | 0 | - | 11 | 0 | - | 0 | - | 0 | - | 0 | - | - | 0 | 63 |
| (4)II | 13 | 29 | 0 | - | 9 | 0 | - | - | - | - | - | 0 | - | - | 0 | 39 | (4)II | 0 | 11 | 2 | - | 8 | 0 | - | - | - | - | - | 0 | - | - | 15 | 54 |
| (15)II | 0 | 4 | 0 | 0 | 25 | 0 | 0 | - | - | - | 0 | 0 | - | 0 | 0 | 62 | (15)II | 16 | 11 | 0 | 0 | 8 | 0 | 0 | - | - | - | 0 | 0 | - | 0 | 0 | 56 |
*(Total numbers in 70´ sec. periods during which individual S.Mystax werw observed to eat particular food items obses in 30 min. periods = 90,20 secs´ totals = 1/90)
Cuadro 3.- Competencia y frecuencia de consumo de alimentos.
|
J M M |
O V E R CO M P E T I T I O N |
TOTAL FRECUENCY OF BOTH EATING SAME FOOD (F) + WATER (W) |
INDIVIDUAL LATENC1ES TO EAT = N° OF 20 SEC. PERIODS. |
||||||
| Shelter | Cage | (D=Drink) F=Food) | M --> F | F --> M | F · W ord | MI ST | FI ST | ||
| I |
I9 |
0 (D) | 0 | 0 | 0 (D) | (F) | 1 = (F) | 0 | 0 |
|
0 (F) |
25 (F) |
(F) |
(F) |
||||||
|
I |
17 | 0 (D) | 2 | 0 | 0 (D) | (F) | (F) | 0 | 0 |
|
2 (F) |
9 (F) |
(F) |
(F) |
||||||
|
I |
20 | 0 (D) | 0 | 0 | 0 (D) | (F) | (F) | 0 | 0 |
|
0 (F) |
20(F ) |
- | - | ||||||
|
I |
9 | 0 (D) | 0 | 0 | 0 (D) | (F) | 1=(F) | 0 |
0 |
|
0 (F) |
19 (F) |
1=(F) |
- |
||||||
|
I |
10 | 0 (D) | 0 | 0 | 0 (D) | (F) | 1=(F) | 0 | 0 |
|
0 (F) |
10 (F) |
(F) |
(F) |
||||||
|
I |
11 | 0 (D) |
0 |
0 |
0 (D) | (F) (F) | (F) | 0 |
0 |
|
0 (D) |
21 (F) |
(F) (F) (F) |
1 = (F)(F)(F) |
||||||
|
I |
I5 | 0 (D) | 1 | 0 | 0 (D) | (F) (F) | 1=(F) (F) |
0 |
0 |
|
1(F) |
25 (F) |
(F) |
(F) (F) |
||||||
|
I |
6 | 0 (D) | 0 | 0 | 0 (D) | (F) (F) | 1(F) 1(F) |
0 |
0 |
|
0 (F) |
43 (F) |
(F) |
(F) |
||||||
| II |
8 |
0(D) | 0 | 0 | 0 (D) | (F) | 1=(F) | 0 | 0 |
|
0 (F) |
6 (F) |
||||||||
|
II |
27 | 0 (D) | 0 | 0 | 4 (D) | (F) | 1 = (F) (D) | 0 | 0 |
|
0(F) |
16 (F) |
1 = (D) |
|||||||
|
II |
22 | 0 (D) | 0 | 0 | 0 (D) | 0 | (F) | 0 | 7 |
|
0 (F ) |
2 (F) |
||||||||
|
II |
3 | 0(D) | 0 | 0 | 0 (D) | (F) | (D) | 0 |
10 |
|
0(F) |
6 (F) |
(D) |
1 = (D) |
||||||
|
II |
6 |
0 (D) | 0 | 0 | 6(F) | (F)(F)(F) |
0 |
0 |
|
|
0 (F) |
12 (F) |
(D)(D) |
(D) |
||||||
|
II |
10 |
0 (D) | 0 | 0 | 0 (D) | 0 | 1 = (F) (F) |
0 |
0 |
| 0 (F) | 11I (F) | (F) | |||||||
|
II |
4 |
0 (D) |
0 | 0 | 0
(D) |
(
F) ( F) ( F) |
0 |
1 | 0 |
|
0 (F) |
3 (F) |
|
|||||||
|
II |
15 | 0 (D) |
0 |
0 |
0 (D) | (F) (F) | (F) (F) |
11 |
1 |
| 0 (F) | 9 (F) | 1= (F) | |||||||
|
|
|
= First |
|
||||||
Cuadro 4.- Competencia y frecuencia de consumo de alimentos.
|
HOB. |
OVER COMPETITION |
TOTAL FREQUENCY OF BOTH EATING SAME |
INDIVIDUAL LATENCY TO EAT = NO OF 20 SECS |
|||||
|
IV |
D =Drink F=Food |
M--aF |
F--M |
Items (F)+Water (D) |
Mi ST |
Fii ST |
||
| (24) I |
0 (D) |
0 | 0 |
0 (D) |
(F) (F) (F) |
1 (F) (F) |
0 | 0 |
|
0 (F) |
10 (F) |
|
|
|||||
| (5) I |
0 (D) |
0 | 0 |
0 (D) |
(F) |
1= (F) 1= (F) |
0 | 0 |
|
0 (F) |
36 (F) |
(F) |
||||||
| (1) |
0 (D) |
0 | 0 |
0 (D) |
(F) |
(F) (F) |
0 | 0 |
|
0 (F) |
22 ( F) |
(F) |
(F) |
|||||
| (17) I |
0 (D) |
0 | 0 |
0 (D) |
(F) |
1=(F)1=(F)1=(F) |
1 | 1 |
|
0 (F) |
3 (F) |
|
||||||
| (21) I |
0 (D) |
0 |
0 |
0 (D) |
0 |
1=(F) (F) (F) |
0 | 0 |
|
0 (F) |
39 (F) |
|
||||||
| (4) I |
0 (D) |
0 |
0 |
0 (D) |
(F) |
1=(F) |
0 | 0 |
|
p (F) |
I7 (F) |
1=(F) 1=(F) |
||||||
| (2) I |
0 (D) |
0 |
0 |
0 (D) |
0 |
1= (F) ,(F) |
0 | 0 |
|
0 (F) |
14(F) |
(F) (F) |
||||||
| (3)I |
0 (D) |
0 | 0 |
0 (D) |
0 |
(F) (F) |
0 | 0 |
|
p (F) |
24(F) |
1= (F) |
||||||
| (22) I |
0 (D) |
0 |
0 |
0 (D) |
(F) |
I = (F) |
0 |
3 |
|
0 (F) |
31 (F) |
(F) |
I = (F) |
|||||
| (12)II |
ó (D) |
2 | 0 |
8 (F) |
(F) |
(D) |
0 |
0 |
|
:0 (D) |
8 (D) |
|
|
|||||
| (19) II |
0 (F) |
0 | 0 |
0(D) |
(F) (F) I = |
0 | 0 |
4 |
|
0 lD) |
9 (F) |
(F) |
|
|||||
| (16)II |
(F) |
0 |
0 |
0 (D) |
0 |
1 |
0 |
|
|
1 (D) |
6 (F) |
|
(F) |
|||||
| (23)II |
0 (F) |
1 |
0 |
7 (D) |
0 |
1=(F) 1=(F) 1 =(D) |
0 |
7 |
|
01 (D) |
6 (F) |
|
|
|||||
| (20) II |
(F)0 |
0 | 0 |
0 (D) |
0 |
I=(F) I=(F) |
0 |
0 |
|
0 (D) |
7 (E) |
|
|
|||||
| (26) ll |
0 (F) |
0 | 0 |
1 (D) |
(F) 3 = (F) |
0 |
0 |
0 |
|
0:00 |
21 (F) |
D |
|
|||||
| (21) II |
(F) |
0 | 0 |
0 |
0 |
0 |
||
|
0 (D) |
0 |
0 |
||||||
| (13)II |
p (F) |
0 | 0 |
0 |
(F) |
1=(F) |
0 | 1 |
|
14 (F) |
1=(F) |
|||||||
Otra forma de evaluar la competición, es contar el número total de períodos en que los dos animales estaban comiendo el mismo tipo de comida. Los Cuadros 3 y 4 muestran los resultados de nuestras observaciones. De éstos se deduce que la incidencia general del consumo del mismo tipo de comida fue baja.
En cuanto a las preferencias relativas de alimentos, hubo variación individual en la elección de tipos de alimento. No obstante, nuestros datos muestran claramente que, por regla general, los alimentos de alto valor nutritivo, por ejemplo el huevo, tenían una aceptación mucho menor que los alimentos como la guava (que es dulce) y, en menor grado, el plátano. También, parecía que los individuos a menudo preferían capturar insectos dentro de la jaula en vez de consumir la comida que se les había proporcionado. Teníamos la impresión que los insectos vivos eran su alimento preferido; sin embargo, el consumo de insectos tiene el riesgo de infestación por parásitos.
La observación de que el huevo era poco preferido fue corroborada por nuestras ocasionales revisiones de la comida que había quedado en las jaulas: encontramos a menudo que habían dejado grandes pedazos de huevo intactos. También otros alimentos, como zanahoria y arveja, fueron raras veces consumidos; pero como no eran suministrados a menudo, no hubo indicios disponibles en cuanto a las preferencias generales. Los alimentos preferidos, tales como la guava, fueron consumidos mayormente durante largos períodos continuos al comienzo de la sesión de observación y fueron a menudo acabados antes de pasar a consumir algún otro alimento.
Comentario general
Hay una interesante diferencia en el comportamiento de las parejas entre los dos galpones. En el Galpón No. 1, las jaulas tienen pisos de malla metálica, colocados aproximadamente a 30 cm sobre el suelo. En este galpón, los monos pasan mucho tiempo en el piso, a menudo comen y no tienen reparos en bajar a recoger los pedazos de comida que se les cae. Sin embargo, hay la desventaja que los pedazos pequeños atraviesan el piso de malla y se pierden. Además, en algunas jaulas las plataformas para la comida son inadecuadas y parte de la comida introducida cae a veces al suelo.
En el Galpón No. 2, en cambio, los animales muestran un desagrado por el piso, que es de concreto y forma parte de la estructura básica de la jaula. Debido a esto, los pedazos de comida que caen al piso, a veces no son recogidos. El tamaño de las tazas para comida de estas jaulas es relativamente pequeño, por lo que los pedazos grandes de comida a menudo se caen al suelo cuando los monos están escogiendo y examinando la comida.
Hay una diferencia nítida en el uso relativo
del espacio entre las parejas de S. mystax que viven en un tipo de jaula,
comparadas con las que viven en el otro tipo. Esto no rige sólo para
las actividades alimentarias sino también para el descanso, despioje
y marcación.

INTERACCIONES SOCIALES EN PAREJAS REPRODUCTIVAS DE Saguinus mystax EN CAUTIVERIO
Rogerio Castro
INTRODUCCIÓN
La información básica sobre comportamiento de Callitrichidae, es el resultado de investigaciones efectuadas bajo cautiverio en laboratorios y zoológicos (Kleiman 1977, Epple 1977, Box 1977, Rothe 1975). Recientes investigaciones de campo (Dawson 1977, Neyman 1977 y Soini et al. 1977), han determinado la densidad y estructura poblacional, así como también algunos aspectos de comportamiento social de Saguinus oedipus y S. mystax. Es muy escasa la información que se tiene sobre patrones de comportamiento del "pichico barba blanca" S. mystax (Castro y Soini 1977, Wolfe et al. 1975); sin embargo, durante los últimos años del Proyecto Peruano de Primatología, se están recolectando suficientes datos acerca de la dinámica poblacional y ecología de esta especie (Soini et al. 1977) con fines de manejo.
En este estudio se ha tratado de investigar algunos aspectos de comportamiento, con la finalidad de que los resultados preliminares puedan ser utilizados para resolver algunos problemas del establecimiento y mantenimiento de la colonia de S. mystax del Centro de Reproducción y Conservación de Primates No Humanos de Iquitos, Perú, cuyas parejas con experiencia reproductiva en el campo han interrumpido esta actividad por razones aún no determinadas.
MATERIAL Y MÉTODOS
Cuatro parejas reproductivas fueron observadas en el Galpón Mystax No. 1 del Centro de Reproducción y Conservación de Primates No Humanos desde el 8 de Abril al 25 de Mayo 1978. La identificación, procedencia y fechas de enjaulamiento se dan en el Cuadro 1. Las cuatro parejas reproductivas están localizadas en jaulas de madera de 1 x 1 x 2 m, colocadas lado a lado para evitar el contacto visual; el piso, techo y frontis son de malla de alambre galvanizado. El interior de cada jaula cuenta con dos perchas horizontales ubicadas a diferentes alturas, y un nidal en el extremo superior derecho.
Cuadro1.- Frecuencias de actividades de cuatro parejas reproductivas de Saguínus mystax (80 horas de observaciones).
|
Jaula |
Sexo |
USO JAULA |
DESCANSO |
MARCAR JAULA |
DESPIOJE |
AGRUPAMIENTO | INSPECCION DE JAULA | ||||||||||||||
|
Nido |
Percha Superior |
Percha Inferior |
PISO |
SENTADO | ECHADO |
PARADO |
Percha Superior |
Percha Inferior |
PISO |
ALIMENTO |
INDIVIDUAL |
SOCIAL |
|||||||||
| Rascarse | Autodespioje | solicita | ANTES | PROXIMOS | |||||||||||||||||
| 23 | 94 | 37 | 76 | 965 | 766 | 203 | 114 | 22 | 36 | 18 | 8 | 58 | 66 | 97 | 30 | 41 | 48 | 818 | 592 | 840 | |
| 188 | 34 | 135 | 808 | 913 | 52 | 93 | 1 | 4 | - | 2 | 81 | 60 | 785 | ||||||||
| 27 | 161 | 109 | 78 | 799 | 820 | 99 | 166 | 8 | 4 | 117 | 47 | 86 | 140 | 119 | 20 | 60 | 75 | 960 | 422 | 795 | |
|
346 |
131 |
l23 |
537 |
713 |
133 |
79 |
6 |
11 |
- |
- |
80 |
166 |
713 |
||||||||
| 29 | 157 | 81 | 81 | 700 | 709 | 77 | 68 | 12 | 11 | 26 | - | 97 | 15 | 101 | 25 | 53 | 62 | 755 | 487 | 722 | |
|
271 |
117 |
130 |
672 |
662 |
82 |
55 |
3 |
2 |
8 |
- |
63 |
6 |
652 |
||||||||
| 3 O | 128 | 82 | 78 | 883 | 732 | 109 | 107 |
16 |
13 | 43 | 24 | 73 | 91 | 105 | 24 | 48 | 63 | 801 | 467 | 813 | |
| 267 | 79 | 129 | 631 | 753 | 93 | 75 | 5 | 3 | - | - | 81 | 72 | 613 | ||||||||
| Total | 540 | 309 | 313 | 3347 | 3027 | 488 | 455 | 58 | 64 | 204 | 79 | 314 | 312 | 422 | 99 | 202 | 248 | 3334 | 1968 | 3I7 | |
|
1072 |
361 |
517 |
2648 |
3041 |
360 |
302 |
15 |
2.0 |
8 |
2 |
305 |
304 |
2713 |
||||||||
| % | 1l,025 | 6,43 | 6,52 | 69,72 | 63,06 | 10,15 | 9,47 | 1,20 | 1,25 | 5,0 | 1,64 | 6,54 | 6,50 | 4,40 | 1,03 | 2,10 | 2,58 | 34,73 | 20,50 | 61,8 | |
| 22,33 | 7,52 | 10,77 | 55,16 | 63,35 | 7,5 | 6,29 | 0,31 | 0,41 | 0,16 | 0,04 | 5,35 | 6,33 | 54,4 | ||||||||
Las jaulas se encuentran en ambientes físicos llamados galpones, con paredes abiertas y techo de calamina. Todo el galpón se encuentra rodeado de malla mosquitero para facilitar la circulación del aire. Para minimizar el stress se evitó el manipuleo del animal. La primera y segunda ración de alimentos fueron asignadas a las 8:30 y 13:00 h, y agua ad-libitum. La limpieza, diaria del galpón y jaulas, se efectuó entre las 16:00 y 17:00 h.
Durante este período, el Servicio Nacional de Meteorología e Hidrología (SENAMHI) registró para el Sector de Iquitos una temperatura promedio de 25,8'C (20,8 - 32,0'C), humedad relativa de 91,5% (44-100%) y precipitación promedio de 17,42 mm.
Las observaciones se efectuaron en días no consecutivos, utilizando formatos preestablecidos para este fin. Las observaciones se ejecutaron durante 80 h, en períodos diarios de 30 min de observación por animal divididos en 60 intervalos de 30 s cada uno. En cada intervalo, se registró una frecuencia para cada categoría de las siguientes actividades de comportamiento (Cuadro 1):
- Uso de jaula. Ubicación del animal en el nido, percha superior, percha inferior y piso.
- Marcación de jaula. Actividad ejecutada en el piso y percha.
-Descanso. Posturas de sentado, echado y parado, relacionado con el uso de la jaula.
-Despioje. Se consideraron dos categorías, (i) individual: rascarse y autodespioje; (ii) social: participación de ambos sexos en la solicitud y acción de despioje.
- Contacto. Ejemplares que estuvieron juntos o en contacto físico y próximos, o sea a una distancia menor que la longitud de la cola, pero sin llegar a rozar sus cuerpos.
RESULTADOS
Existen diferencias significativas de comportamiento de la actividad de descanso entre machos y hembras (X2 obs. 314,90, 7,815). No existen evidencias para rechazar las diferencias individuales entre hembras, entre machos y entre parejas en el uso de cada uno de los cuatro sectores de la jaula, ya que parecen comportarse en forma diferente (X2 = 16,91) durante la actividad de descanso.
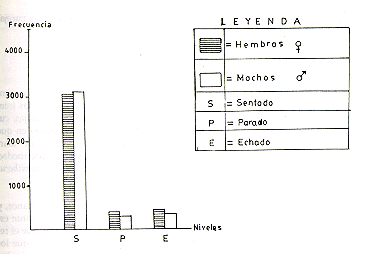
Las diferencias significativas de comportamiento de la actividad de descanso entre machos y hembras (XI 0,05=7,378), entre hembras y entre machos y entre parejas (XI 0,95, 14,023 = X2 0,5, 14,436), confirman las diferencias individuales entre cada uno de los ejemplares observados. Las hembras con mayor frecuencia que los machos descansan tomando posturas de echadas y paradas, mientras que en los machos la postura de sentado tiene mayor frecuencia. En ambos sexos, la posturas de sentado y echado están relacionadas con la actividad de despioje social, y la posturas de sentado y parado también tienen relación con la actividad de inspección de jaula, la cual parece tener mayor frecuencia en las hembras que en los machos (Fig. 1).
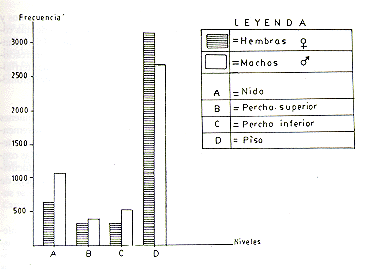
La marcación de pisos, perchas y alimentos es mucho más frecuente en las hembras que en los machos (XI obs. 30,435>7,378); las diferencias individuales, significativas entre hembras, entre machos y entre parejas (X2 0,05 9,348= 14,512), confirman que durante el período de observación, esta actividad fue preponderante en las hembras. El estado de excitación que esta actividad provoca en la hembra, estimulada por factores externos y/u hormonales, ocasionalmente hacen que la hembra miccione durante el marcaje; cuando esto ocurre el macho se acerca al lugar marcado-orinado para olerlo y lamerlo. Durante la actividad de marcación de pisos y perchas, fueron dos posturas las que con mayor frecuencia se observaron: (i) posando solamente la región genital sobre el sustrato (pisos, perchas, comedero y alimentos) con la cola proyectada hacia atrás para facilitar la actividad durante el avance y (ii) en similar postura que la anterior, pero los movimientos fueron laterales (Fig. 2).
Aparentemente, no existen diferencias significativas de frecuencias de la actividad de despioje individual entre machos y hembras (X2 obs. 0,0056<5,024), pero sí existen diferencias individuales entre ejemplares del mismo sexo; por lo general, esta no frecuente actividad (rascarse y autodespioje) tiene muy corta duración y se efectuó mayormente en la posición de sentadas en el piso, y también en perchas. El despioje social tiene estrecha relación con la frecuencia de solicitud de despioje. Durante el tiempo de observación, fueron los machos los que con mayor frecuencia despiojaban a las hembras, y las hembras las que con mayor frecuencia solicitaron el despioje. No se han encontrado diferencias significativas de despioje social y de solicitud de despioje (X2 obs. 0,252<9,348) en las cuatro parejas observadas.
Las frecuencias de la actividad de contacto fueron
menores durante las horas que se servía el alimento y se aumentaban durante
el descanso y despioje. Las mayores frecuencias de contacto se obtuvieron cuando
los animales estuvieron en el piso y nido; la actividad estuvo caracterizada
por su larga duración y se presentaron diferencias de comportamiento,
en relación a esta actividad, en las parejas observadas (X2 obs.
42,330>9,348). Las frecuencias que se registraron cuando estuvieron próximos
para cada una de las parejas reproductivas (Fig. 3).
DISCUSIÓN
Los resultados reflejan que en Saguinus mystax existen diferencias de comportamiento individual entre ejemplares del mismo grupo social; las interacciones de contacto reflejan familiaridad e intimidad entre las parejas, cuyas frecuencias de contacto pueden incrementarse en circunstancias en que la temperatura es baja, durante el descanso y despioje, voces de alarma. Kleiman (1977) menciona que durante el estrés, preñez y enfermedad también aumentan las frecuencias de contacto para el caso de Leontopithecus rosalia.
Para la actividad de despioje, los animales utilizan una o ambas manos, y con la ayuda de la boca cogen los ectoparásitos o algo similar; durante esta actividad, el ejemplar que despioja permanece sentado mientras que el receptor puede estar sentado o mayormente echado. Indudablemente que los machos prestan atención a las hembras cuando éstas solicitan ser despiojadas, mientras que las hembras no siempre actúan de la misma manera a solicitud del macho.
Epple (1977) menciona que hay incremento de contactos entre machos y hembras en presencia de extraños, esto como probable resultado de una coordinación que motiva acciones agresivas de la pareja en contra del visitante, como una reacción de comportamiento territorial que estimula marcaciones, cuyas funciones son interpretadas como mecanismos de defensa territorial y competición sexual, las que son comunicadas a través del olor (feromonas).
Estos criterios son corroborados por Box (1977) y Kleiman (1977), quienes mencionan que las frecuencias de marcaciones de las hembras se incrementan durante la preñez en conexión con un incremento de comportamiento territorial. En nuestra colonia no debe descartarse la posibilidad de que las continuas marcaciones que efectúan las hembras pueda alterar la productividad de Saguinus mystax; en reiteradas oportunidades se observó que luego de una excitación nerviosa de la colonia, las marcaciones por las hembras se sucedían.
La diferente utilización de jaula por el
macho y la hembra puede inferir la hipótesis que en el medio ambiente
natural existen diferencias sexuales en el uso del nicho ecológico. Los
resultados de las frecuencias registradas en este trabajo, implican que en la
estratificación vertical son los machos los que con mayor frecuencia
ocupan partes más altas de los árboles, tal vez con el objeto
de tener un mayor dominio visual y control de su área de actividades.
Cambios climáticos como fuertes vientos y lluvia provocan reacciones
nerviosas en la colonia de S. mystax, y al iniciarse estos cambios se escuchan
frecuentes vocalizaciones de contacto.
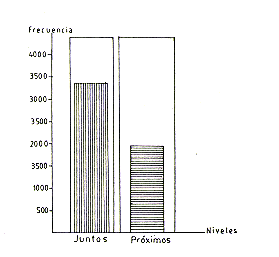
Fig. 3.-Gráfico comparativo de frecuencia de la actividad agrupamiento.
REFERENCIAS
Box, H. 0. 1977. Social interaction family groups of captive marmosets. pp. 239-
249. En D.G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Washington, D.C.
Castro, R. y P. Soini. 1977. Field studies on Saguinus mystax and other Callitrichids in Amazonian Perú. pp. 73-78. En D. G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Wash., D.C.
Dawson, G.A. 1977. Composition and stability of social groups of the tamarin, Saguinus oedipus geoffroyi in Panama: Ecological and behavioral implications. pp. 2337. En D.C. KJeiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Washington, D.C.Epple, G. 1977.
Notes on the establishment and maintenance of the pair bond in Saguinus fuscicollis. pp. 231-237. En D.G.Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Washington, D.C.
Kleiman, D. G. 1977. Characteristic of reproduction and sociosexual interactions in pairs of lion tarnarins (Leontopithecus rosalia) during the reproductive cycle. pp. 181-190. En D.G. Kleiman. (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Institution Press, Washington, D.C.
Neyman, P.F. 1977. Aspects of the ecology and social organization of free-ranging Cotton - top tamarins (Saguinus oedipus) and the conservation status of the especies. pp. 39-71. En D.C. Kleiman (Ed.). The Biology and Conservation of the CaIlitrichidae. Smithsonian Institution Press, Washington, D.C.
Soini, P., R. Aquino, F. Encamación, L. Moya y J. Tapia. 1977. poblacional y reproducción de Saguinus mystax (Callitrichidae) en la cuenca del Río Manití. II. Densidad poblacional de Cebuella pygmaea (Callitrichidae) en la cuenca del Río Manití. Informe sobre estudios primatológicos 1976-1977. Ministerio de Agricultura. Iquitos. 25 pp.
Wolfe, L.G., F. Deinhardt, J.D. Ogden, M.R. Adams y L.E. Fisher
1975. Reproduction of wild-caugth and laboratory-born marmosets species used
in biomedical research (Saguinus sp., - Callithrix jacchus). Lab. Anim. Sci.
25(6) : 802-813.

PARASITOS DE PRIMATES PERUANOS: HELMINTOS DEL "MONO FRAILE" Y DEL "PICHICO BARBA BLANCA" *
(Publicado en Boletín de Lima 27(5):54-58. Mayo 1983).
Myriam Horna y Manuel Tantaleán
INTRODUCCIÓN
Las especies de primates platyrrinos Saimiri sciureus (Cebidae) y Saguinus mystax mystax (Callitrichidae) tienen enorme significado para las investigaciones biomédicas.
Se conoce que la parasitosis en los primates no humanos resulta ser una de las principales causas de su elevada tasa de mortalidad en colonias establecidas. Los que logran sobrevivir disminuyen su potencial como animales de laboratorio (Cosgrove et al. 1963, Deinhardt y Deinhardt 1966, Deinhardt et al. 1967). Existen escasas referencias a especies peruanas (Dunn 1963, Dunn y Lambrecht 1963), en algunos Callitrichidae (Cebuella pygmaea, Saguinus nigricollis) y en Cebidae (Aotus sp., Ateles paniscus, Cebus sp., Lagothrix sp., Saimiri boliviensis, S. sciureus).
En el presente trabajo se trata por primera vez de los parásitos hallados en Saguinus mystax mystax. En el caso de Saimiri sciureus, se tuvo la oportunidad de trabajar con un alto número de ejemplares.
MATERIAL Y MÉTODOS
Los ejemplares de primates estudiados provienen del Departamento de Loreto. Los ejemplares de Saguinus mystax mystax "pichico barba blanca", fueron atrapados en el Río Manití (73º 05' 0 y 03º 45'S); y los de Saimiri sciureus, en la Reserva Nacional Pacaya-Samiria (74' 25'0 y 05' 17S). Se efectuaron los exámenes en individuos que murieron al llegar al Centro de Reproducción y Conservación de Primates de IVITA, Iquitos. La carga parasitaria está íntimamente relacionada al stress y al cambio de dieta sufrida por los mamíferos al ser extraídos de su hábitat natural; por ello es probable que, en ciertos casos, el deceso se haya debido a los parásitos.
Se colectaron helmintos de 11 machos y 9 hembras de "pichicos barba blanca" y de 40 "monos frailes" de ambos sexos. Los nemátodos y los acantocéfalos se lavaron en suero fisiológico y una vez fijados y preservados en alcohol glicerinado, se aclararon para su estudio en alcohol-fenol. Los céstodes, que fueron expulsados por el recto junto con el material fecal, se fijaron en formol 10%, previo relajamiento; luego se prepararon láminas permanentes coloreadas con carmín de Semichón o Hematoxyna Delafield.
Para la determinación taxonómica se usaron especímenes adultos preservados. Las observaciones se hicieron en microscopio de contraste de fases; los dibujos, usando cámara lúcida y las mediciones con un ocular micrométrico calibrado; todos Carl Zeiss.
RESULTADOS
Se identificaron 7 especies de helmintos: un céstodo, cinco nemátodos y un acantocéfalo.
Cestoda
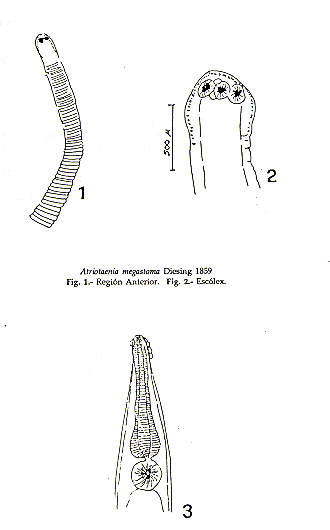
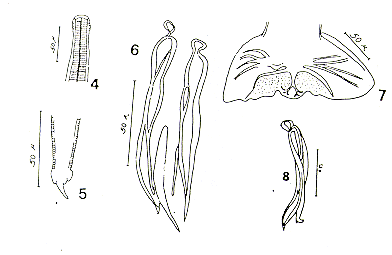
1. Atriotaenia megastoma Diesing 1859. (Figuras 1 y 2).
Material estudiado: Col. Helmint. IMT No. 585 (sólo del "mono fraile").
Hábitat: Intestino delgado del "mono fraile". Es una de las ocho tenias de la Familia Anoplocephalidae conocidas como parásitas de Saimiri sciureus (Dunn 1963, 1968). El género Atriotaenia tiene como sinónimo Mathevotaenia (Stunkard 1961, 1965), y la familia de los anoplocefálidos figuran como las tenias más características de los monos del Nuevo Mundo.
Nematoda
2. Trypanoxyurus(T.)sceleratus(Travassos 1925),Inglis & Dunn 1964.(Fig.3).
Material estudiado: Col. Helmint. IMT No. 586 (sólo del "mono fraile").
Hábitat: intestino grueso del "mono fraile"
Perteneciente a la Familia Oxyuridae, este nemátode es conocido de varias otras especies de primates (Inglis y Dunn 1964). Tiene como sinónimo a Enterobius sceleratus Travassos 1925. Cameron (1929) redescribe la especie en Saimiri sciurcus; una revisión del género (Inglis y Dunn 1964) colocó a la especie en Trypanoxyurus.
3. Molineus elegans (Travassos 1921) Travassos & Darriba 1929. (Figs. 4, 5, 6, 7 y 8).
Material estudiado: Col. Helmint. IMT No. 430 (del "pichico") y No. 587 (del "mono fraile").
Hábitat: intestino delgado, en ambos primates.
Perteneciente a la Familia Trichostrongylidae, y fue identificada primero en Saimiri sciureus y luego en Cebus sp. Es una especie ampliamente conocida (Schmidt 1965, Skrjabin et al. 1954, Skrjabin 1964, Travassos 1921).
4. Dipetalonema (D.) gracile (Rudolphi 1809) Diesing 1861. (Figs. 9, 10, 11 y 12).
Material estudiado: Col. Helmint. IMT No. 380 y No. 417 (del "pichico") y No. 588 (del "mono fraile").
Hábitat: Cavidad abdominal de ambos primates.
Perteneciente a la Familia Setaridae, es una de las especies de filarias ya conocidas de Saimiri sciureus (Chabaud 1952, Chabaud y Bain 1976, Cha
lifoux et al. 1973, Dunn y Lambrecht 1963, Tantaleán
1976) y uno de los endoparásitos más comunes de Saguinus m. mystax,
y en general de primates platyrrinos. La filariasis es una de las formas más
características de parasitismo por nemátodos en monos platyrrinos.
El tamaño de esta especie varía de acuerdo al hospedero (Dunn
y Lambrecht 1963). Las características del material estudiado coinciden
con la morfoanatomía anotada por otros autores (Chabaud 1952, Chabaud
y Bain 1976, Skrjabin 1949). En algunos ejemplares machos estudiados por nosotros,
no son claramente visibles las papilas medias impares de la punta de la cola
y muestran ligeras modificaciones en la disposición de las papilas cloacales.
Estos detalles los interpretamos como variaciones interespecíficas, probablemente
debidas al hospedero.
Dipetalonema (D). gracile (Rudolphi 1809) Diesing 1861.
Figuras: 9.-Región anterior de la hembra; 10. Vista ventral
de la región de la cloaca; 11 y 12. Cola de la hembra.
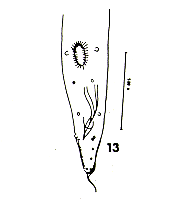
5. Primasubulura jacchi (Diesing 1860) Inglis 1958. (Fig. 13).
Material estudiado: Col. Helmint. IMT No. 249 (del "pichico").
Hábitat: ciego del "pichico".
Esta especie de la Familia Subuluridae es conocida de otros primates con el nombre de Subulura jacchi (Yarnaguti 1961), hallada en Saguinus geofftoyi de Panamá (Thatcher y Porter 1968) y en Callithrix aurita coelestis de Brasil (Pinto 1970). Inglis (1958) creó el género Primasubulura para los Oxyúridos de primates. Los escasos ejemplares fueron identificados en base al espécimen macho (longitud total, esófago, número y disposición de las papilas en la cola, presencia de ventosa precloacal y alas cervicales). Las medidas del gobernáculum varían mucho de las dadas por Pinto (1970): 0,17 mm, siendo las nuestras de 0,6 - 0,7 mm.
6. Spirura guianensis (Ortlepp 1924).
Material estudiado: Col. Heimint. No. 428 (de "pichico").
Hábitat: estómago del "pichico".
Esta especie de la Familia Spiruridae fue descrita como Spirura
tamarini (Cosgrove et al. 1963) y obtenida como parásito de Tamarinus
(Saguinus) nigricollis en la foresta Perú-Colombia-Brasil. Posteriormente,
ejemplares obtenidos de Saguinus geoffroyi en Panamá fueron examinados
por Thatcher y Porter (1968), llegando a la conclusión que S. tamarini
es coespecífica con S. guianensis.
Primasubulura jacchi
(Diesing 1861) Inglis 1958.
Fig. 13.-Vista ventral.de la región posterior del macho.
Los ejemplares examinados poseen características que coinciden con las anotadas por otros autores (Cosgrove et al. 1963, Quentin y Krishnasamy 1975) que consideran como características principales la presencia de un reborde cuticular con cinco dientes bucales bífidos. Los otros caracteres son: longitud total de hembras y machos, longitud de espículas, estructura de la región anterior, número y disposición de las papilas caudales del macho, tamaño y forma de los huevos.
Acanthocephala
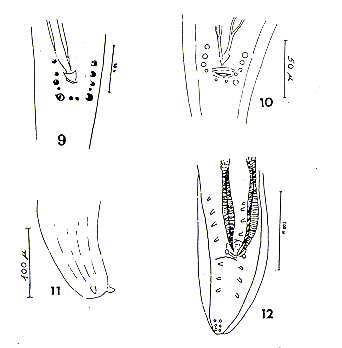
7. Prosthenorchis elegans (Diesing 1851) Travassos 1915. (Figs. 14,15,16,17, 18, 19).
Material estudiado : Col. Helmint. IMT No. 381 a-b (del "pichico") y No. 589 (del "mono fraile").
Hábitat : Íleum, del "pichico", íleum + ciego del "mono fraile".
Este acantocéfalo de la Familia Oligacanthorrynichidae pertenece a un género muy importante como parásito de primates neotropicales. Dunn (1963) lo registró por primera vez en el Perú en Saimiri sciureus. Porter (1972) lo consigna para Saguinus m. mystax pero no da a conocer procedencia.
La Fig. 14 muestra las características propias del género Prosthenorchis: región anterior del presoma con un collar festonado y ganchos barbados. Schmidt (1972) considera sólo 3 especies: fraterna, lemuri, elegans. Nuestros ejemplares corresponden a las características de elegans dadas por otros autores (Dollfus 1938, Machado 1950, Travassos 1917). Solamente parecería haber una pequeña diferencia con Machado (1950) quien no describe la presencia de barbas en los ganchos y nosotros las encontramos en todos ellos; además nuestros ejemplares son de menor tamaño, lo que se atribuye a la influencia del hospedero o a la edad del parásito.
Este acantocéfalo es la especie parásita
más dañina del "mono fraile" (García 1976, Tantaleán
1976). En muchos hospederos, la cantidad de acantocéfalos encontrada
fue tan grande que obstruía el íleon y el ciego; y probablemente
la muerte se produjo por la presión mecánica de los gusanos que
llegan a peRíorar la pared intestinal (Fig. 19); y como consecuencia
de la peritonitis así provocada.

REFERENCIAS
Cameron, M.A. 1929. The species of Enterobius Leach, in rimates.I.Helminthol.7:161182-
Chabaud, A.G. 1952.
Le genre Dipetalonenta Diesing 1861: essai de classification. Ann. Parasit. Hum. Comp. 27: 250-285.
Chabaud, A.C. y 0. Bain. 1976. Le ligned Dipetalonema. Nouvel essai de classification. Ann. Parasit. 51: 365-697.
Chalifoux, L.V., R.D. Hunt, P.C. Carcfa, PK Schgal, y J.R. Comiskey. 1973.
Marlasis in New World monkeys: histochernical differentiation of circulating microfilariae. Lab. Anim. Sci. 23: 211-220.
Cosgrove, C., B. Nelson, y A. Jones. 1963. Spirura tamarini sp.n. (Nematoda, Spiruridae) from an amazonian primate, Tamarinus nigricollis (Spix 1823). 1. Parasit. 49: 1010-1013.
Deinhardt, F. y J. Deinhardt. 1966. The use of platyrrhine monkeys in medical research. Symp. Zool. Soc. London 17. 127-152.
Deinhardt, F., M. Holmes, J. Devine y J. Deinhardt. 1967. Marmosets as laboratory animal. IV. The Microbiology of laboratory kept marmosets. Lab. Anim. Care 17. 4870.
Dollfus, V. 1938. Etude morphologique et systernatique de deux especes d'acanthocéphales, parasites de lemuriens et de signes. Revue critique du genre Prosthenorchis Travassos. Ann. Parasit. 16: 385-422.
Dunn, F.L. 1963. Acanthocephalans and cestodes of South American monkeys and marmosets J. Parasit. 49: 717-722.
Dunn, F.L. y F.L. Lambrecht. 1963. On some filarial parasites of South American primates, with a description of Tetrapetalonenia tamarinae n.sp. from the peruvian marmoset, Tamarinus nigricollis (Spix 1823). 1. Helminth- 37: 261-286.
Dunn, F.L. 1968. The parasites of Saimiri: pp. 31-68. En L. Rosenblum y R. Cooper (Eds.). The context of platyrrhine parasitism. Acad. Press, New York.
Garcia, F. 1976. Primate husbandry and reproduction. pp. 55-56. En First InterAmerican Conference on Conservation and Utilization of American Nonhuman Primates in Bio-Medical Research. Scientific Publication No 317: 55-56. Wash, D.C.
Inglis, W. 1958. The comparative anatomy of the subulurid head (Nematoda): with a consideration of its systematic importance. Proc. Zool. Soc. London 130: 577-604.
Inglis, W.C. y F.L. Dunn. 1964. Some oxyurids (Nematoda) from neotropical primates. Z. Parasitenk 24: 83-87.
Machado, F. 1950. Revis5o do género Prosthenorchis Travassos 1915 (Acanthocephala). Mern. Inst. Osw. Cruz 48: 495-544.
Pinto, M. 1970. Ocurrencia de Subulura jacchi (Marcel 1857) Raillict & Henry 1913 (Nomatoda: Subuluroidea) em novo hospedeiro: Callithrix aurita coelestis (M. Ribeiro 1924). Atas da Sociedade de Biologia do Rio de Janeiro 13: 143-145.
Porter, J. 1972. Parasits of marmosets. Lab. Anim. Care 22: 503-506.
Quentin, J. y M. Krishnasamy. 1975. Nemátodes Spirura parasites des Tupaia,et du Nycticébe en Malaisie. Ann. Parasit. 50: 795-812.
Schmidt, G. 1965. Molineus mustelae sp.n. (Nematoda: Trichostrongylidae) from the long-tailed weasel in Montana and,M. chabaudi nom, n. with a key to the species of Molineus. 1. Parasit. 51: 164-174.
Schmidt, G. 1972. Revision of class Archiacathocephala Meyer 1931 (Phyllum Acanthocephala) with emphasis on Oligacinthorhynchidae Southwell et Macfie 1925. 1. Parasit 58: 290-297.
Skrjabin, K.I. 1949. Key to parasitic nematodes. Vol. 1. Spirurata and Filariata. Acad. Sci. URSS Transi. ISRAEL Prog. Sci. Transl. 497 pp.
Skrjabin, K.I., N.P. Shiknobalova, y R.S. Shul'ts. 1954. Essentials of nematodology III. Thrichostrongylids of animals and man. Acad. Sci. URSS Moscow Trans]. 1960. Nat. Sci. Foun. and U.S. Dept. Agric. Wash., D.C.
Skrjabin, K.I. 1964. Trichostrongylidao of animals and man. Vol. 111. Acad. Sci. URSS Transl. ISRAEL Prog. Sci. Transl. 704 pp.
Stunkard, H.W. 1961. Cycloskrjabinia taborensis (Loewen 1934) a cestode from the red bat, Lasiurus borealis (MUller 1776) and a review of the family Anoplocephalidae. 1. Parasit. 47: 847-856.
Stunkard, H.W. 1965. Paratriotaenia oedipomidatis gen. et sp.n. (Cestoda), from a marmosct. 1. Parasit. 51: 545-5,51.
Tantaleón, M. 1976. Contribución al conocimiento de los helmintos de vertebrados del Perti. Biota 10: 437443.
Thatcher, V. y J. Porter, J. 1968. Some helminth parasites of Panamian primates. Trans. Amer. Microsc. Soc. 87: 186-196.
Travassos, L. 1917. Contriibuiçoes para o conhecimiento da fauna holmintológica brasileira VIll Revisao dos acantocefalos brasileiros. Part. I Fam. Giganthorhynchidae Hamman 1892. Mem. Inst. Osw. Cruz. 9: 5-60.
Travassos, L. 1921. Contribuiçõnes para o conhecimiento da fauna helmintológica brasileira XIII. Ensaio monográfico da Familia Trichostrongylidae, Leiper 1909. Mein. Inst. Osw. Cruz. 13. 5-133.
Yamaguti, S. 1961. Systema Helminthum. Ill. The nematodes
of vertebrates. Part. I y II. 1261 pp., 909 Figs. Intersci. Pub. ,Ed. New York.
VALORES HEMATICOS NORMALES DE Saimiri boliviensis peruviensis y Cebus apella MANTENIDOS EN CAUTIVERIO EN EL CENTRO DE REPRODUCCION Y CONSERVACION DE PRIMATES NO HUMANOS (CRCP), IQUITOS, PERU.*
(* Presentado en Congreso Zoología, Arequipa (1983).
Carlos Málaga, Myriam Horna, Enrique Villavicencio y Jaime
Moro.
INTRODUCCIÓN
A pesar que los monos del Viejo Mundo son utilizados con más frecuencia en investigación biomédica, recientemente han cobrado importancia los monos del Nuevo Mundo, en razón de su menor costo de adquisición y mantenimiento, y de su mayor facilidad de manejo. Entre estos destaca el mono fraile, Saimiri boliviensis peruviensis, utilizado en investigación biomédica como modelo para el estudio de las enfermedades del hombre, para el control de la eficacia e inocuidad de drogas y productos biológicos. El machín negro, Cebus apella, es otra especie de importancia biomédica, se le utiliza en neurología y en estudios de Malaria, así como "lazarillo" para el cuidado de personas impedidas.
Para que un mono sea utilizado como animal experimental se requiere del conocimiento de sus parámetros fisiológicos normales, que son ampliamente conocidos en especies del Viejo Mundo, como el "Rhesus", pero prácticamente desconocidos para las especies del Nuevo Mundo. El presente estudio busca determinar los valores normales para los parámetros hemáticos más usuales de dos especies de importancia biomédica, el Saimiri boliviensis peruviensis y el Cebus apella.
MATERIAL Y MÉTODOS
Se seleccionaron, previo examen para determinar el buen estado sanitario, 38 ejemplares adultos de S. boliviensis peruviensis (7 machos y 31 hembras) y 19 C. apella (4 machos y 15 hembras), que tenían por lo menos un año de cautiverio en la colonia de reproducción CRCP, alimentados con la dicta PAHO-0879 (Cuadro l), suplementada con frutas y agua ad-libitum, sin considerar a las hembras preñadas o con crías lactantes.
Cuadro 1. - Composición de la dieta PAHO-0879
|
19,2% |
|
12,8% |
|
13,4% |
|
9,8% |
|
19,7% |
|
4, 9% |
|
4, 9% |
|
9,8% |
|
2,9% |
|
2,5% |
Para la toma de muestras se adormeció a los animales con Clorhidrato de Ketamina (Ketalar) a razón de 10 g/kg de peso. La muestra de sangre (2 m1) fue tomada de la vena femoral con agujas Nº 22 y colocada en frascos evacuados (Vacuntainer) conteniendo EDTA como anticoagulante, para determinar los siguientes parámetros hemáticos : Eritrocitos. La cuenta de hematíes se realizó siguiendo la técnica descrita para el uso de la cámara Neubauer mejorada.
Hemoglobina.
La determinación de hemoglobina se hizo utilizando el hemoglobinómetro "Hb-Meter" de la American Optical, siguiendo la técnica descrita por los fabricantes.
Hematocrito. Fue determinado centrifugando la muestra en microcapilares por 5 minutos a 10 000 rprn, utilizando una microcentrífuga International Microcapilar Modelo MB". La lectura se hizo por comparación con patrones Criptocap.
Volumen Celular Medio (MCV), Hemoglobina Celular Media (MCH) y Concentración Celular Media de Hemoglobina (MCHC). La determinación de estos índices fue hecha con los resultados obtenidos por los procedimientos arriba descritos, siguiendo las fórmulas establecidas para cada índice.
Leucocitos. La cuenta de glóbulos blancos se realizó siguiendo la técnica descrita para el uso de la cámara Neubauer mejorada.
Cuenta Diferencial. La fórmula leucocitaria fue determinada en base al promedio de cuatro cuentas de 100 células, dos en cada uno de los frotis preparados.
Proteína Sérica. La determinación de
la proteína sérica se efectuó siguiendo la técnica
descrita por la National Instrument Company para su proteinómetro portátil,
que fue usado para esta determinación.
RESULTADOS Y DISCUSIÓN
Saimiri boliviensis peruviensis
A pesar de las varias referencias bibliográficas existentes sobre valores hemáticos normales de Saimiri sp., la mayoría de los autores presentan sus resultados sin indicar la especie o subespecie de Saimiri, identificándolas, en el mejor de los casos, por su lugar de origen o características fenotípicas, lo que ocasiona una gran variación en los resultados.
Para los efectos de comparación, en el Cuadro 2,,se presentan los valores hemáticos obtenidos en el presente trabajo para Saimiri boliviensis peruviensis (Hershkovitz 1983), así como aquellos reportados por otros autores. Los valores obtenidos para el número de glóbulos rojos y blancos por mm3 hematocrito y concentración de hemoglobina, son similares a los reportados por Suzuki (1981) y Capel-Edwards y Hall (1970). Sin embargo, la fórmula leucocitaria sólo coincide con los valores reportados por New (1968).
Existe variación significativa con y entre los valores hemáticos reportados por otros autores (Ausman et al. 1976, Colillas y Arzuaga 1981, Peoples et al. 1969, Vogin y Oser 1971) puede deberse, al menos parcialmente, al hecho de que los valores corresponden a los animales del mismo género pero de diferente especie. También, el tiempo transcurrido entre su captura en el medio ambiente natural y la toma de la muestra puede influir en los resultados reportados. Cabe notar que el 24,4% de las muestras fueron positivas a hemoparásitos, correspondiendo éstos a los géneros Dipetalonema y Tetrapetalonema.
Cebus apella
La bibliografía referente a valores hemáticos normales de Cebus sp., es limitada. Los valores obtenidos en el CRCP para Cebus apella se presentan en el Cuadro 3, donde se comparan con los reportados por Porter (1971) para Cebus capuchinus, y por Samonds et al. (1974) para Cebus apella. Ninguna de las muestras presentó microfilarias.
Cuadro 2.- Valores llemáticos Normales para Saímiri sp., según diferentes autores
Promedio ± Desviadón Estándar
| Autor | GR x 106 | GB x 103 | Hto (%) |
Hb (g/100 ml) |
Neutrófilos (%) |
Linfocitos (%) |
Manocitos (%) |
Eosinófilos (%) |
Basófilos (%) |
MCV fl. |
MHC pg |
MCHC (%) |
Proteína (g/100 ml) |
| Este estudio N = 38 A |
6,68 ± 0,7 | 9,26 ± 3,2 | 37,0 ± 3,9 | 13,9 ± 1,6 | 41,0 ± 14,6 | 51,6 ± 15,4 | 0,73 ± 0,8 | 6,5 ± 8,3 | 0,05 ± 0,22 | 56,27 ± 7,7 | 21,0 ± 3,2 | 37,2 ± 6,7 | 7,8 ± 0,6 |
| Capel-Edwards y Hall (1970) N =31 B |
6,87 ± 0,6 | 11,2 ± 5,2 | 41,1 ± 3,3* | 13,7 ± 1,2 | 52,7 ± 16,8* | 38,9 ± 11,3 | 2,0 ± 1,8* | 6,2 ± 6,1 | 0,1 ± 0,3 | 59,9 ± 39* | -- | 33,4 ± 1,4 | -- |
| Manning et al. (1969) N = 102 B |
7,0 ± 1,0 | 6,2 ± 2,4* | 4,2 ± 6,4 | 13,6 ± 2,2 | 62,0 ± 1,9* | 34 ± 15,2* | 3,0 ± 2,4 | 2,0 ± 3,0 | 0 | 60,0 ± 4,2 | -- | 32,0 ± 1,4* | 7,8 ± 0,7 |
| New (1968) N = 67 C |
8,3 ± 0,6 | 8,2 ± 2,4 | 46,9 ± 2,4 | 14,8 ± 0,8* | 41,2 ± 13,8 | 51,9 ± 13,7 | 1,2 ± 1,3 | 5,3 ± 5,2 | 0,3 ± 0,7* | 57,1 ± 3,8 | 18,1 ± 1,1* | 31,7 ± 1,1* | 7,3 ± 0,6* |
| Suzuki (1981) N = 34 1N - 65 D |
7,12 ± 0,5 | 11,2 ± 2,7 | 40,3 ± 5,3 | 13,5 ± 1,0 | 1* 26,8 ± 12,1 |
1* 66,3 ± 12,7 |
1 1,2 ± 1,2 |
1 5,5 ± 5,1 |
1 0,2 ± 0,3 |
-- | -- | -- | 7,63 ± 1,6 |
* = Diferencia significativa P< 0,05 (t student bicola)
|
A |
Sairniri boliviensis peruvien |
|
B |
Especie Indeterminada |
|
C |
Isrovemiientes de Leticia, Colombia, Saímiri sciureus macrodon. |
|
D |
Provenientes de Perú, Arco Romano, Saimiri boliviensis peruviensis. |
Cuadro 3.- Valores Hemáticos Normales para Cebus apella, según diferentes autores
Promedio ± Desviación Estándar
| Autor | GR x 106 | GB x 103 | Hto (%) |
Hb (g/100 ml) |
Neutrófilos (%) |
Linfocitos (%) |
Manocitos (%) |
Eosinófilos (%) |
Basófilos (%) |
MCV fl. |
MHC pg |
MCHC (%) |
Proteína (g/100 ml) |
| Este estudio n= 19 A |
5,45 ± 1,0 | 11,34± 5,7 | 39,9 ± 4,7 | 13,4 ± 1,9 | 36,6 ± 16,5 | 50,4 ± 18,0 | 4,5 + 3,6 | 7,2 + 5,6 | 1,5 + 1,6 | 75,3 + 13,4 | 25,0 + 3,1 | 33,6 + 3,1 | 8,5 + 1,6 |
| Porter (1971) N = 14 1N = 11 B |
4,92 + 0,7 | 14,16 + 8,6 | 47,0 + 6,7* | 14,4 + 1,8 | 55,6 + 6,6 | 40,9 + 6,7 | 1,8 + 1,1 | 1,6 + 2,2 | 0,0 | 96,7 + 0,9 | 29,7 + 1,7 | 30,9 + 2,2 | -- |
| Samonds et al. (1974) N = 44 A |
6,36 + 0,6* | 8,4 + 3,3* | 49,1 + 3,8* | 16,6 + 1,4* | -- | -- | -- | -- | -- | 78,8 + 4,4 | 26,7 + 1,7 | 33,6 + 1,9 | 8,5 + 0,6 |
* = Diferencia significativa P< 0,05 (t student bicola)
A Cebus apella
B Cebus capucinus
RESUMEN
Con la finalidad de determinar los valores hemáticos del
mono fraile o ardilla, Saimiri boliviensis peruviensis, y del mono capuchino
o machín negro, Cebus apella, bajo una situación de cautiverio,
se mostró 38 animales adultos (7 machos y 31 hembras) de la primera especie
y 19 animales adultos (4 machos y 15 hembras) de la segunda especie, todos provenientes
de las colonias del CRCP, donde tenían por lo menos un año de
cautiverio. Las muestras de sangre, tomadas de la vena femoral de animales anestesiados
con Clorhidrato de Ketamina, fueron examinados en el laboratorio del CRCP, determinándose
los parámetros hemáticos más usuales.
REFERENCIAS
Ausman, L.M., D.L. Gallina, K.C. Hayes y D.M. Hegsted. 1976. Hematological development of the infant squirrel monkey (Saimiri sciureus). Folia Primatol. 26: 292300.
Capel-Edwards, K. y D.E. Hall. 1970. Hernatological observations on the squirrel monkey. Folia Primatol. 12: 142-160.
Colillas, 0J. y E. Arzuaga. 1981. Valores sanguíneos del Saimiri sciureus, variedad boliviana. Rev. Med. Vet. 62(4).
Manning, P.J., N.D.M. Lehner, M.A. Fedner y B.C. Bullock. 1969. Selected hematologico, serum chemical and arterial blood gas characteristics of the squirrel monkeys JSaimiri sciureus). Lab. Anim. Care 19-.831-837.
New, A.E. 1968. Base line blood determinations of the squirrel monkey (Saimiri sciureus). pp. 417419. En L.A. Rosenblum y R.W. Cooper (Eds.). The Squirrel Monkey. Academic Press, New York.
Peoples, A., M. Cranmer y M. Miller. 1969. Determination of baseline blood values of the squirrel monkey (Saimiri sciureus). Lab. Primate Nezosl. 8: 14.
Porter, J.A. 1971. Hematologic values of the black spider monkey (Ateles fusciceps), red spider monkey (Ateles geoffroyi), white-faced monkey (Cebus capucinus) and black howler monkey (Alouatta villosa). Lab. Anim. Sci. 21: 426-433.
Samonds, K.W., L.M. Ausman y D.M. Hegsted. 1974. Hernatological development of the Cebus monkey (Cebus albifrons and C. apella). Folia Primatol. 2: 72-79.
Suzuki, T. 1981. Clinical laboratory studies on blood properties of the squirrel monkey (Saimiri sciureus). The First Tsukuba Primate Center Symposium. Normal Data of Laboratory Primates, 1. Med. Sci. and Biol. 34: 237-270.
Vogin, E. y F.F. Oser. 1971. Comparative blood
values in several species of nonhuman primates. Lab. Anim. Care 21:937-941.

REARREGLOS CROMOSOMICOS Y VARIABILIDAD CARIOTIPICA DEL GENERO Aotus (Cebidae: Platyrrhini)*
(*Presentado en 1985).
Jaime Descailleaux, Ricardo Fujita, L.A. Rodríguez, Rolando
Aquino y Filomeno Encarnación
INTRODUCCIÓN
Las especies del género Aotus (Cebidae: Platyrrihini) presentan determinadas características, que las han convertido en organismos muy apreciados para experimentos biomédicos, destacando entre ellas un comportamiento "sui géneris" ante los parásitos de la malaria, así como ser hasta la fecha los únicos monos nocturnos descritos.
Hasta la década del 70, Aotus fue considerado como género monotípico con solamente A. trivirgatus; sin embargo, el hallazgo de cariotipos polimórficos (Brumback et al. 1971, Ma et al. 1976) obligó a los especialistas a una exhaustiva revisión de la sistemática y a la fecha han logrado establecer la existencia de por lo menos 9 especies y 4 subespecies, que presentan distribución geográfica determinada y fenotipos característicos, mostrando además una gran variabilidad cariotípica con números diploides que oscilan entre 46 y 56 cromosomas, conformando 10 cariotipos diferentes, 9 de ellos descritos hasta 1978 (Ma et al. 1978) y el décimo reportado recientemente en el 11 Congreso Brasileiro de Primatología por Descailleaux et al., en Enero de 1985.
La identificación de las poblaciones de Aotus, se realiza primariamente en base a las tonalidades de coloración del pelaje ventral del cuello, que de acuerdo al predominio del gris o del rojizo, permite clasificarlos en dos grandes grupos: con cuello gris o con cuello rojo; sin embargo, la diferenciación intragrupo requiere de otros criterios, siendo el análisis citogenético el que mejor establece las diferencias interespecíficas.
El Centro de Reproducción y Conservación de Primates No Humanos de Iquitos (CRCP) del Instituto Veterinario de Investigaciones Tropicales y de Altura (IVITA) de la Universidad Nacional Mayor de San Marcos (UNMSM), tiene como uno de sus objetivos, la reproducción en cautiverio de las poblaciones de Aotus, y para el establecimiento de las parejas reproductoras adecuadas, se ha iniciado un programa de colaboración con el Laboratorio de Genética Humana de la Facultad de Ciencias Biológicas-UNMSM, a fin de establecer el cariotipo de aquellas poblaciones de Aotus, en las que el examen de la morfología externa no permite discriminar, asegurando de esta manera la formación de parejas isocariotípicas y, al mismo tiempo, evitando las posibles barreras reproductivas de naturaleza cromosómica.
MATERIAL Y MÉTODOS
La población estudiada fue de 82 ejemplares del género Aotus, todos procedentes del CRCP del IVITA-UNMSM-Iquitos; 68 del tipo cuello gris, identificados por sus características moRíológicas externas como A. vociferans, y los 14 restantes del tipo cuello rojo, identificados como A. nancymai. La selección de los animales a estudiar fue realizada en base a las necesidades del CRCP;,primando el criterio de la posibilidad de identificación sin análisis cromosómico, lo que explica el mayor número de animales de tipo cuello gris.
Para el análisis citogenético, utilizamos la técnica de cultivo de linfocitos,de la sangre periférica, según Moorhead et al. (1960), modificada por Dutrillaux y Couturier (1981) y las coloraciones empleadas fueron Giemsa al 2%, RHG, CBG y RTBHG (ISCN 1978, Viegas-Pequignot y Dutrillaux 1978).
RESULTADOS
Los resultados obtenidos en la población estudiada (Cuadro l), nos muestran la existencia de 4 cariotipos, uno con 46 , otro con 47, un tercero con 48 y el cuarto con, 54 cromosomas; los 3 primeros en el grupo cuello gris (A. vociferans) y el de 54 en el grupo cuello rojo (A. nancymai).
De los 4 cariotipos encontrados, dos de ellos han sido reportados en la década del 70, siendo que el de 46 cromosomas corresponde al K-V de la clasificación propuesta por Ma et al. (1976) y el de 54 al K-1 del mismo autor, mientras que el de 48 es más reciente, habiendo sido reportado por primera vez en el II Congreso Brasileiro de Primatología en Enero de 1985 por Descailleaux et al., y posteriormente por Ma et al., a fines de 1985.
La comparación de los cariotipos encontrados en el grupo cuello gris (A. vociferans), nos indica que existe una homología total o casi total en todos los miembros del cariotipo, y la única diferencia encontrada es derivada de la existencia de un cromosoma metacéntrico grande en el cariotipo de 46, que se corresponde exactamente con 2 acrocéntricos medianos del cariotipo de 48, lo que nos muestra la ocurrencia de una translocación robertsoniana (t rob) o fisión céntrica.
Cuadro 1.- Resultados obtenidos en los 82 animales
citogenéticarnente analizados.
|
Cariotipo |
Fenotipo |
Identificación |
N° de animales |
| 46 | Cuello gris | Aotus vocíferans | 32 |
| 47 | id. | id. | 1 |
|
48 |
Id. |
id. |
35 |
| 54 | Cuello rojo | A. nancymay | 14 |
El cariotipo de 47 cromosomas apareció en un único ejemplar
de sexo femenino y corresponde a la forma híbrida derivada de un cruzamiento
entre individuos de 46 y 48 cromosomas. En relación al cariotipo de 54
cromosomas, podemos afirmar que exhibe diferencias notables con los 3 anteriores,
y que el análisis comparativo aún no ha sido completado, fundamentalmente
por algunas incertidumbres para la identificación de los cromosomas más
pequeños, pudiéndose afirmar que, además del par sexual
que es idéntico en todos los cariomorfos encontrados, un metacéntrico
mediano que exhibe una notable constricción secundaria en la región
próxima al telómero del brazo largo aparece en los 4 cariotipos.
DISCUSIÓN
Nuestros resultados confirman que la gran variabilidad en el número diploide del género Aotus, es consecuencia de una gran frecuencia de translocaciones robertsonianas (o fisiones céntricas), las mismas que han posibilitado la diferenciación de 11 cariotipos, (considerando el cariotipo a 47 como el NI, 11) algunos de ellos perfectamente establecidos y que, en algunos casos, muestran correspondencia con fenotipos externos que los diferencian específicamente.
Los cariotipos a 46 y 48 cromosomas aparecen prácticamente con la misma frecuencia (32/68; 35/68), mientras que el de 47 cromosomas fue encontrado en un único ejemplar 1/68), y aunque más de una hipótesis puede explicar su origen, nos parece que la más probable es la que postula que es la resultante de un cruzamiento de los cariotipos mayoritarios y bien establecidos: 46 x 48, y este hallazgo, nos demuestra por otro lado la viabilidad de este cariotipo.
La evaluación de rol que desempeñan
las transiocaciones robertsonianas en el proceso de la especiación, como
un mecanismo involucrado en el establecimiento de un aislamiento reproductivo
de tipo cromosómico, necesariamente debe considerar en primera instancia
el análisis teórico del comportamiento del rearreglo durante la
meiosis. Si admitimos que el rearreglo ocurrió en la población
original una única vez, con la formación de un ejemplar con 47
cromosomas, y que a partir de éste han surgido todos los individuos poseedores
del 2do. cariotipo, es lógico suponer que no debe existir una barrera
reproductiva de naturaleza cromosómica absoluta entre los 2 cariotipos,
pudiendo por lo tanto señalarse que la mutación cromosómica
habría ocurrido una única vez en la población original,
que por ahora no puede ser cariotípicamente precisada, ya que en la direccionalidad
que el proceso hubiera seguido, ambas vías son igualmente probables.
|
fisión |
segregación |
|
|
46----------------------------------------------- |
47--------------------------------------------- |
48 |
|
segregación |
fusión |
El análisis meiótico en los portadores de translocaciones robertsonianas, nos muestra que apenas 1 de los 3 tipos posibles de segregación, forma gametos balanceados, sea con el cromosoma transiocado o con los acrocéntricos, pero originando en ambos casos individuos normales; los otros tipos producirían gametos desbalanceados que darán origen a individuos trisómicos o monosómicos que indudablemente constituyen formas inviables o estériles en el mejor de los casos.
Para buscar antecedentes del comportamiento de este tipo de rearreglo cromosómico en otras especies, es necesario volver la mirada al Homo sapiens, que constituye sin duda alguna el organismo con mayor información epidemiológica; en efecto, las translocaciones robertsonianas aparecen con una frecuencia aproximada de, 1 por cada 1000 recién nacidos vivos, y a pesar de que un portador sano de una translocación tipo D/G tiene teóricamente 2/3 de probabilidad de tener descendencia anormal; los cuadros estadísticos muestran que el riesgo de un portador de la t rob de tener un hijo afectado, es menor que el estimado teóricamente, y aún más, varía con el sexo del portador, siendo de 1 al 5% en caso de ser varón y de 16 a 20% si es mujer (Giraud y Mattei 1975, Grouchy y Turleau 1982).
Adicionalmente, el análisis citogenético de la descendencia normal de los portadores de una t rob nos muestra que existe una transmisión preferencial de la forma translocada con respecto a los cromosomas normales, todo lo cual nos estaría mostrando que de alguna manera, por mecanismos no bien determinados, se estaría favoreciendo el establecimiento de este rearreglo, de manera contraria a lo que ocurre con otros, como las inversiones pericéntricas por ejemplo.
De acuerdo a los datos de Aquino y Encarnación (1988), los cariotipos a 46 y 48 cromosomas comparten el mismo hábitat (simpátricos) y por lo expuesto, deducimos que los 2 cariomorfos pueden cruzarse y tener descendencia con 47 cromosomas, evento que estaría representando al camino inverso que recorriera naturalmente la diferenciación de los 2 cariotipos.
Los individuos a 47 cromosomas, pueden cruzarse indistintamente con individuos de 46, 47 ó 48 cromosomas, en todos los casos, el 50% de la descendencia tendrá 47 cromosomas, y el 50% restante tendrá 46 (25%), ó 48 (25%), lo que representa indudablemente una desventaja para el establecimiento de este cariotipo en términos poblacionales, sobre todo si consideramos que del,cruce 46 x 46, ó 48 x48, se originan únicamente individuos del tipo parental, con el añadido que los gametos producidos serán con mayor frecuencia viables. Todos estos considerandos nos sugieren que los individuos de 47 cromosomas representan un "puente" entre los cariotipos de 46 y 48, obligatorio en un "momento evolutivo", pero que muy difícilmente pueden llegar a alcanzar dimensión poblacional comparable a los anteriores.
REFERENCIAS
Aquino, R. y F. Encarnación. 1988. Population densities and geographic distribution of Aotus nancyrnai and Aotus vociferans (Cebidae: Primates) in Northeastern Peru. Anwr. 1. Prirnatol. 14: 375-385.
Brumback, R.A., R.D. Staton, S.A. Benjamin y C.M. Lang. 1971. The chromosomes of Aotus trivirgatus Humboldt 1812. Folia Primatol. 15: 264-273.
Descailleaux, J., R. Fujita, R. Aquino y F. Encarnación. 1985. Un nuevo complemento cromosómico para el género Aotus. II Congreso Brasileíro de Primatología, Campinas-Libro Resúmenes, p. 387.
Dutrillaux, B. y J. Courturier. 1981. La practique de Fanalyse cytogenetique. Ed. Mason (París).
Ciraud, F. y J. F. Mattei. 1975. Aspects epidemiologiques de la trisomie 21. 1. Genet. Hum. 23: 1-30.
Grouchy, J. de y C. Turleau. 1982. Atlas des maladies chromosomiques. Expansión Scientifique Francaise.
Hershkovitz, P. 1983. Two new species of night monkeys Genus Aotus (Cebidae, Platyrrhini). A preliminary reports on Aotus taxonorny. Arner. 1. Prírnatol. 4: 209-243.
ISCN. An International system for human cytogenetic nomenclature, 1978. Birth Defects original article series, Vol. 14, NQ 8 (The National Foundation, New York). También en: Cytogenet. Cell Genet. 21: 309-404.
Ma, N.S.F., T.C. Jones, A.C. Miller, L.M. Morgan y E.A. Adams 1976. Chromosome polymorphism and banding pattern in the owl monkeys (Aotus). Lab. Animal Sim 26: 1022-1036.
Ma, N.S.F., R.N. Rossan, S.T. Kelley, J. S. Harper, M.T. Bedard y T.C. Jones. 1978.
Banding patterns of the chromosomes of two new karyotypes of the owl monkey, Aotus, captured in Panama. 1. Med. Primatol. 7: 146-155.
Ma, N.S.F., R. Aquino y W.E. Collins. 1985. Two now karyotypes in the peruvian, owl monkeys (Aotus trivirgatus)., Amer. 1. Primatol. 9: 333-341.
Moorhead, P.S., P.C. Howell, W.J. Mellman, D.M. Battips y D.A. HungeRíord. 1960. Chromosomes preparations of leukocytes culture from human peripheral blood. Exp. Cell. Res. 20: 613-616.
Viegas-Pcquignot, E. y B. Dutrillaux. 1978. Une methode simple
pour obtenir desprophases et des prometaphases. Ann. Genet. (París) 21:
122-125.

