

Tema III: TRABAJOS EN SEMICAUTIVERIO EN ISLAS
RESULTADOS DE UNA INVESTIGACIÓN PRELIMINAR DE LA
FAUNA DE LA ISLA DE IQUITOS E ISLAS ADYACENTES
( La versión original presentada al Ministerio de Agricultura
en Octubre de 1975).
Pekka Soini
INTRODUCCIÓN
Entre el 5 y el 28 de Setiembre 1975 se hicieron
4 viajes a las islas denominadas Isla de Iquitos, Padre Isla, Isla Padre Cocha
e Isla Buenos Aires, situadas en el Río Amazonas frente a la Ciudad de
Iquitos, con el fin de realizar un estudio preliminar de la macrofauna existente
y especialmente para determinar la existencia y el estado de poblaciones de
primates, recorriendo 121 km a pie en 16 días. También se obtuvo
datos sobre los asentamientos humanos y sus actividades en relación a
la fauna. Las distancias recorridas y el tiempo empleado en las principales
actividades de investigación fueron los siguientes :
|
- |
Censo diurno de primates | 94,85 km | 79:43 horas |
|
- |
Censo nocturno de primates | 3,94 km | 2:45 horas |
|
- |
Censo de playas tortugueras | 18,87 km | 11:10 horas |
|
- |
Ubicación de animales fuera de censo | 3,66 km | 13:08 horas |
En el presente informe, se presentan los métodos de estudio empleados,.los resultados obtenidos y algunas recomendaciones referentes al futuro manejo y conservación de la fauna en estas islas (Fig. l).
MÉTODOS
Censo de primates
Se abrieron en la Isla de Iquitos 18 transectos, procurando que éstos estén equidistantes uno del otro. Para los censos se utilizó el método por transectos descrito por Freese (1975). Los transectos no siempre fueron paralelos, debido a las extensas cochas (lagos) y fangales en el interior de la isla, factores que en muchos casos determinaron la ubicación y dirección del transecto. En Padre Isla, se abrieron 3 transectos, en Isla Padre Cocha 2 y en la Isla Buenos Aires solo 1 transecto. Aproximadamente el 30% del kilometraje total recorrido en el censo de la isla principal era por terrenos abiertos y/o frecuentados por el hombre (caseríos, sembríos, caminos principales, etc.), donde la probabilidad de hallar manadas de monos era nula o casi nula.
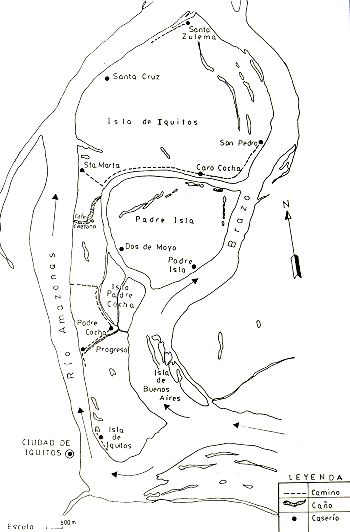
Fig. 1.- Mapa de las Islas y las ubicaciones
de los asentamientos humanos en ellas.
El conteo completo de individuos de las manadas de Saimiri sciureus fue difícil de lograr porque: (i) los integrantes de la manada andaban muy dispersos, sobre todo los machos adultos tendían a mantenerse bastante alejados del núcleo de la manada principal; (ii) eran muy ariscos y huían tan pronto detectaban la proximidad del observador, lo que muchas veces ocurrió antes de que éste lograra verlos; (iii) al empezar la huida se dispersaban en 2 grupos y se alejaban en direcciones opuestas, imposibilitando el conteo total. Sin embargo, se logró contar todos o casi todos los individuos en 48% de los encuentros con manadas de Saimiri.
También se experimentó con el censo nocturno de Aotus, con resultados prometedores. Sin embargo, esta especie requiere estudios adicionales antes de poder establecer los parámetros necesarios para los cálculos de densidades poblacionales, porque resulta difícil determinar el tamaño de las manadas encontradas sin ayuda de instrumentos de observación nocturna. En la Fig. 2 están representados los transectos y las ubicaciones de las manadas de primates encontradas.
Ronsocos
Se registró los lugares donde habían "caminos", "bañaderos', heces y pisadas frescas de ronsoco (Hydrochoerus hydrochaeris). A base de las huellas y marcas se trató de estimar aproximadamente el tamaño de cada manada. Los datos de ubicación están representados en la Fig. 3.
Lagartos
Durante censos diurnos por transecto se observó 5 lagartos (Caiman crocodilus), de los cuales 3 fueron capturados y examinados para determinar la especie, estado reproductivo en el caso de las hembras, morfometría y luego soltarlos. La captura de estos animales es relativamente fácil porque en esta temporada las cochas se encuentran secas y los lagartos se entierran en el fango, de donde no se mueven aun cuando uno se acercara. La ubicación de éstos dentro del fango requiere rastreo cuidadoso.
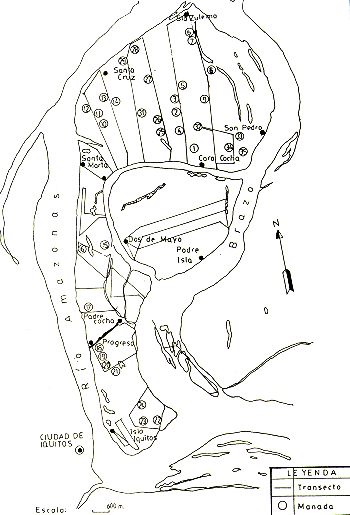
Fig. 2. - Las ubicaciones aproximadas
de los transectos de censo de primates en las islas y
las ubicaciones aproximadas de las manadas de Saimiri scireus
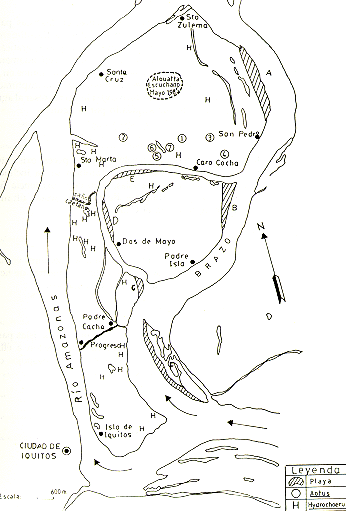
Fig. 3.- Las ubicaciones aproximadas de los grupos de Aotus sp. y de
Hidrocherus hidrochaeris
observados y de las playas de desove de Podocnemis unifilis y P. sextuberculata
en las islas.
Quelonios
Se recorrió y revisó a pie todas las playas existentes en las islas para determinar si éstas eran utilizadas por quelonios para el desove. Se estimaron la longitud y el máximo ancho de las playas con medida de pasos, graficándolas en la Fig. 3. Algunas de las playas fueron revisadas repetidamente durante el período del estudio. Por las huellas que dejan los quelonios en la arena se puede deducir (i) la especie, (ii) si desovó o no, (iii) si fue capturado por la gente antes o después de haber desovado, o (iv) si logró regresar al agua después de desovar, y M si el nido fue saqueado por la gente.
Inventario de la fauna
Se preparó una lista de los vertebrados (excluyendo los peces) existentes en las islas, en base a observaciones personales. También se ha incluido especies que no se llegó a observar en las islas, pero cuya existencia fue indicada repetidamente por varios habitantes de las islas (estas últimas especies están marcadas con asterisco en el Cuadro l).
Identificaciones botánicas
Las especies de plantas fueron identificadas en base a sus nombres vernaculares, salvo algunas especies de las cuales se recogieron muestras de herbario, que fueron posteriormente identificadas por un botánico.
Información proporcionada por lugareños
Durante los censos se visitó todos los caseríos existentes en las islas para obtener información sobre la fauna y sus actividades en relación a ella. Asimismo, se tomó nota de la presencia de armas de fuego, despojos de animales cazados, etc., dentro y alrededor de las viviendas.
RESULTADOS
Breve caracterización de las islas
1. Isla de Iquitos:
Longitud total 17,8 km
Ancho máximo 7,7 km
Ancho mínimo 950 m
Superficie total 52,74 km2
Cuadro 1.- lista de vertebrados (excepto peces)
registrados en la Isla de Iquitos en 1975.
|
||
| Marsupialia | Caluromys lanatus | Chosna pericote |
| idelphis marsupialis | zorro | |
| Philander opossum | zorrillo, (chusco ñauhui) pericote | |
| Marmosa sp. | pericote, pericotillo | |
| Chiroptera | Varias especies | murciélago, masho |
|
*Alouatta seniculus | coto |
| Aotus sp. | musmuquI | |
| Saímiri sciureus | frailes | |
|
*Tamandua tetradactyla | shihui |
| Cyc1opes didactylus | pelejillo, tapia pelejiflo | |
| Bradypus tridacty1us | pelejo, yacu pelejo | |
|
Holochz7us brasiliensis | ratón, ratón bayano |
| Proechimys brevicauda | ratón, sachacuy | |
| Isothrix bistriatus | pichico maman, cantinero | |
| Mesomys hispidus | casha-ucucha, ratón | |
| DactyIomys dacty1inus | cono-cono | |
| Hydrochoerus hydrochaerís | ronsoco | |
| CAendau bicolar | cashacushillo | |
|
Potos fiarus | chosna |
|
Inia geoffirensis | bufeo colorado |
|
Sotalia fluviatilis |
bufeo negro |
|
|
Trichechus inunguís | vaca marina |
|
||
|
Crypturellus undulatus | panguana |
|
Egretta thula | garza blanca chica |
| Ardea cocol | garza ceniza, uchpa garza | |
| 19utoride~5 StHatus | garza zoquito, sauri | |
| Tígrisoma lineatum | puma garza | |
| Mesembrinibís cayennensí . 5 | ooro-coro | |
| Cochlearíus cochlearius | huapapa | |
| Pilherodius pileatus | garza | |
| Agamía agami | garza, guanayo | |
|
Anhima cornuta | camungo |
| Falconiformes | Cathartes aura | rinahui |
| C~thartes burrovianus(?) | rinahui | |
| Daptrius ater | shihuango negro | |
| Milvago chimachima | shihuango blanco | |
| C-oragyps atratus | gallinazo | |
| Rostrhamus sociabilis | gavilán chequecito | |
| Pandion haliaetus | tibe marnan | |
| Busarellus nígricollis | coto gavilán, mamatúa | |
| Buteo magnirostris | gavilán teretaño | |
| Herpetotheres cachinnans | gavilán | |
|
Eurypyga helias | tanfilla |
| Heliornis Mica | yacu patito | |
| Aramides cajanea | unchala | |
|
lacana spinosa | tuqui-tuqui |
| Hoploxypterus cayanus | timelo | |
| Phaetusa simplex | tibe grande | |
| Sterna superciliaris | tibe chico | |
|
Columba cayennensis(?) | paloma |
| Columbidae | paloma | |
| Columbigallina talpacoti | palomita | |
|
Brotogeris cyanoptera | pihuicho cachete rojo |
| Brotogeris sanctithomae | pihuicho de frente amarilla | |
| Brotogeris versicolurus | pihuicho ala blanca | |
| Amazona sp. (?) | loro | |
| Graydidascalus brachyurus | ojé lorito | |
| Pionites melanocephala | chirriclé | |
|
Crotophaga aní | vaca muchacho |
| Crotophaga major | locrero | |
| Piaya cayana | chicua | |
|
Otus choliba | urcututo |
|
Pulsatrix perspicillata |
lanchina |
|
|
Chordeiles rupestris | paparo |
|
Nyctibius griseus(?) |
ayaymama |
|
|
Trogon collaris | canaura |
|
Trogon melanurus |
canaura |
|
|
Trochilidae | picaflor (plomizo) |
|
Anthracothorax nigricollis |
picaflor verde |
|
|
Ceryle torquala | catalán grande |
| Chloroceryle amazona(?) | catalán mediano | |
| ChIoroceryle aenea | catalán chico | |
|
Galbalcyrhynchus leucotís | |
| Calbula tombacea | ||
| Monasa nigrifrons | tahuicuro | |
| loteroglossus castanotis | tabaquero, pinsha chica | |
| Melanerpes cruentatus | carpintero (orejas amarillas) | |
| Phloeoceastes melanoleucos | carpintero moñudo grande | |
| Celeus elegans | carpintero marrón | |
| Celeus flavus | carpintero amarillo | |
| Chrysoptilus punctigula | carpintero | |
| Capito aurovirens | budúc común, artillero | |
|
Pítangus sulphuratus | víctor díaz |
| Ramphocelus nigrogularís | huanchaco | |
| Xiphocolaptes promeropirhynchus(?) | ||
| Xiphocolaptes griseicapillus (?) | ||
| Sitiasomus griseicapillus(?) | ||
| Pitangus lictor | pisfitoquín | |
| Donacobius atricapillus | gramalote pishco | |
| Ceplialopterus ornatus | toro pisheo | |
| Furnarius torridus | alcalde, margarita | |
| Campylorhamphus trochílirostris | hormiguero | |
| Thraupis episcopus | sul-sul | |
| Cotinga maynana | cielo pishco | |
| Cacícus cela | paucarillo, chana | |
| Psarocolius angustifrons | paucar, bocholocho | |
| Gymnoderus foetidus | pava pishco | |
| Ramphocelus carbo | huanchaco negro | |
|
||
|
Conatodes humeralis | lagartija, salamanca |
| Mabuya mabouya | lagartija | |
| Iguana iguana | camaleón | |
| Anolis fuscoauratus | lagartija, salamanca | |
| Anolis ortoní | lagartija | |
| Prionodacty1us argulus | lagartija | |
| Kentropyx calcaratus | uculluqui, lagartija | |
| Ameiva ameiva | uculluqui, lagartija | |
| Dracaena guianensis | camaleón colorado | |
| Tupinambis teguíxin | iguana | |
|
*Boa constrictor | mantona |
| *Eunectes murinus | boa, boa negra | |
| Chironius carinatus | afaninga verde | |
| Chíronius multíventris | afaninga, taruna | |
| Clelia clelia | afaninga negra | |
| Helicops sp. | yacu jergón | |
| Pseustes sp. | afaninga, taruna | |
| Spilotes pullatus | iguana machaco | |
| Bothrops atrox | jergón | |
| Bothrops bílineatus | loro machaco | |
|
*Ceochelone denticulata | motelo |
| *Kinosternon scorpioídes | ashria charapa, loro charapa | |
| Podocnemis sextuberculata | cupiso | |
| Podocnemis unifilis | taricaya | |
| Chelus fimbríatus | mata-mata | |
|
Caiman crocodilus | lagarto blanco, challua lagarto |
|
*Melanosuchus niger |
lagarto negro |
|
|
||
|
Pipa pipa | charapa sapo |
| Bufo marinus | sapo, sapo ticti | |
| Bufo typhonius | sapito | |
| Leptodactylus pentadactylus | hualo | |
| Leptodactylus wagneri | ||
| Elachistoclesis cf. bicolor | ||
| Dendrobates quinquevittatus | ||
| Dendrobates pictus | ||
| Colostethus marchesianus | ||
| Adenomera marmarata | ||
| Sphaenorhynchus carneus | ||
| Phrynohyas venulosa | ||
| Hyla calcarata | ||
| Hyla cruentomma | ||
| Hyla Jasciata | ||
| Hyla garbeí | ||
| Hyla lanciformis | ||
| Hyla rostrata | ||
| Hyla rubra | ||
| Hyla punctata | ||
| Hyla sp. (rubra complex) | ||
| Hyla sp. (microcephala complex) |
La isla está formada por extensos bajiales y numerosas lagunas, canales, terrenos altos de inundación estacional llamados restingas. La mayoría de las lagunas son de forma alargada, con orientación longitudinal o diagonal en relación a la forma de la isla, y están separadas entre sí por "restingas" anchas o angostas que constituyen los terrenos más elevados y, en muchos casos, también los suelos más antiguos. Desde el año 1970, el nivel del caudal del Río Amazonas es alto en los meses de invierno y toda la isla queda inundada, incluyendo las restingas más elevadas, cuando el río alcanza su máximo nivel, entre Abril-Junio. Las restingas más elevadas quedan cubiertas por una capa de agua de 10-30 cm, mientras que los terrenos bajos sufren inundaciones de varios metros de profundidad. Las orillas de las islas están formadas por barrancos altos (restingas), bajiales y playas.
La vegetación de las restingas consiste mayormente en bosque alto, heterogéneo y maduro, con abundancia de árboles voluminosos y de más de 30 m de altura, formando un dosel cerrado. También los bajiales más elevados presentan un bosque alto y heterogéneo, caracterizado por la presencia de especies de árboles como: quinilla, timareo, espintana, capirona, capinurí, ojé, renaco, lagarto-caspi, quillo-sisa, lupuna, punga, pucaquiro, cunchi-moena, ayahuma, tamamuri, charichuelo, huito, tamara, sacha-anona, cetíco, parinari, catahua, remo-caspi, cumala, loro-micuna, tangarana, ubos, shimbillo, taricaya-shimbillo, copallo y otras. Los bosques de restinga y tahuampa alta carecen de palmáceas, salvo en la zona centro-meridional donde, curiosamente, abundan shebón y shapaja (Scheelea sp.); mientras que en las orillas bajas de las lagunas y bajiales fangosos abundan la ñejilla (Bactris spp.) y la huiririma (Astrocaryum jauari). La isla no presenta aguajales; y los únicos aguajes (Mauritia flexuosa) observados aparentemente habían sido plantados. En muchas restingas se observaron extensas purmas, que indicó la existencia de sembríos de yuca y plátano antes de 1970.
Los terrenos más bajos presentan una vegetación menos heterogénea, formada por pungales (Bombax aquaticum), renacales (Ficus spp.), ceticales (Cecropia spp.), huiririmales (Astrocaryum jauari), rayabalsales (Montrichardis arborescens) y gramalotales (Paspalum spp.). Las restingas bajas, de reciente formación, presentan un bosque de dosel más abierto, formado por árboles de cetico (Cecropia sp.), ojé (Ficus sp.), amasisa (Erythrina sp.) y otros. El estrato bajo consiste en tupidas formaciones de bijau (Heliconia sp.) y gramalote.
2. Padre Isla:
Longitud total 5,2 km
Ancho máximo 4,4 km
Superficie total 15 kM2
Tiene 5 lagunas mayores, de forma alargada, que atraviesan la isla en dirección paralela (Este-Oeste). Estas se encuentran separadas entre sí por restingas, de las cuales algunas se inundan de sólo 10 a 20 cm durante el nivel más alto. En las dos restingas más altas, que bordean a la Laguna Pastor, encontramos sembríos abandonados (purmas recientes) con frutales como caimitos, mangos, sachamangos, pomarrosas, sinamillos, pijuayos, guavas, guayavas, macambos, cacaos, pan del árbol y guineos. La mayoría de estas especies no toleran las inundaciones; sin embargo, estaban en buen estado, lo que indica que la inundación de estas restingas es de poca duración. El bosque natural de las restingas lo forman árboles grandes como ayahuma, cunchi-moena, capinurí, capirona, huito, ubos, shimbillo, yutubanco, renaco, ojé, algunas especies de cedro y otras. Hay extensos bajiales, con vegetación similar a la de Isla Iquitos. Las orillas están formadas por barrancos altos, bajiales y playas.
3. Isla Padre Cocha:
Longitud total 3 km
Ancho máximo 1,8 km
Superficie total 3 km2
Está separada de la isla principal por un canal de 10-15 m de ancho, denominado "Resistencia". Se encuentra dividida longitudinalmente en tres partes por dos lagunas (actualmente secas), que se comunican con el río por ambos extremos. Tiene dos restingas de poca altura, una de las cuales presenta bosque alto y heterogéneo, como árboles de ojé, capirona, capinurí, amasisa, pashaco, cetico, entre otros. Las orillas están formadas por bajiales, una playa y barrancos bajos.
4. Isla Buenos Aires:
Longitud total 3,5 km (aprox.) Ancho máximo 0,8 km (aprox.) Superficie total 2 a 3 km(aprox.)
La isla está dividida por varios canales y una laguna longitudinal. Toda la orilla occidental consiste en una playa amplia. El extremo meridional de la orilla es barranco de poca altura y la orilla oriental está formada por barranco bajo, y bajial o playa el extremo septentrional. Solamente el extremo meridional de la isla presenta bosque de mediana altura formado por ceticos y amasisas. La vegetación de la parte central Y septentrional es mayormente arbustiva y se compone casi exclusivamente de pájaro-bobos y sauces. La mayor parte de la isla está ocupada por ganadería de búfalos, perteneciente a la Universidad Nacional de la Amazonía Peruana (UNAP).
Habitantes
En las islas existen actualmente 10 caseríos, ubicados de la siguiente manera (Fig 1):
1. Isla Iquitos:
Caro Cocha
Isla de Iquitos
Padre Cocha
Progreso
San Pedro
Santa Cruz
Santa María (Zona I y Zona II)
Santa Zulema2. Padre Isla:
Dos de Mayo
Padre Isla3. Isla Padre Cocha:
3 viviendas pertenecientes a Caserío Padre Cocha.
4. Isla Buenos Aires:
1 vivienda, propiedad de UNAP, para el cuidador de los búfalos.
Se estima que el total de familias en las islas asciende a más de 200.
Muchos de los pobladores trabajan en la Ciudad de Iquitos. Otros se trasladan a vivir en las islas temporalmente durante el sembrío y cosecha del arroz, o para la temporada de pesca (Agosto-Setiembre). Las actividades principales de la población estable son la agricultura y la pesca. La agricultura es esencialmente estacional, ya que casi todos los terrenos quedan inundados en el invierno (Diciembre-Mayo). La planta principal de cultivo es el arroz. Otros cultivos importantes son sandía, yuca, maíz. También se pudo observar algunos pequeños cultivos de zapallo, maní, plátano y guineos. Cabe mencionar que antes de 1970, la isla principal tenía grandes cultivos de plátano y frutales. Los animales domésticos que criaban eran gatos, perros, chanchos, gallinas y patos. No se observó ganado vacuno, salvo búfalos de la UNAP en la Isla Buenos Aires.
Fauna
La macrofauna de las islas, excluyendo los peces, la constituyen las aves como las más abundantes, tanto en número de especies como individuos, ocupan los principales hábitats disponibles en las islas. Las especies de aves encontradas en mayor abundancia fueron tuqui-tuqui (Lacana spinosa), pihuichos (Brotogeris spp.), locrero (Crotophaga major), paucar (Cacicus cela) y muchos otros Passeriformes. Entre los mamíferos predominan los monos frailes (Saimiri sciureus) y musmuquis (Aotus sp.), ronsocos (Hydrochoerus hydrochaeris), ratones (Echimyidae y Cricetidae) y murciélagos. Entre los reptiles, hay mayor abundancia de lagartos (Caiman crocodilus), taricayas (Podocnemis unifilis) e iguanas (Tupinambis teguixin). La última especie es el único vertebrado que se observa abundante en el suelo de los bosques.
Los mamíferos y aves encontrados representan una fauna típica de orillas, playas, lagunas, bajiales y tahuampas, es decir, de vegetación baja o alta, sujeta a inundaciones periódicas. Las especies propias de altura están ausentes; así mismo las especies de mamíferos que migran a las tahuampas y bajiales durante el verano están ausentes. Esto último se debe indudablemente a dos factores: el aislamiento de las alturas y la presencia humana en las islas. Sin embargo, según nos informaron varios lugareños, en el verano del año 1973 una manada de huanganas (Tayassu tajacu) entró a la isla principal a nado por el extremo septentrional. Durante la permanencia de la manada en la Isla, varios ejemplares fueron cazados y los restantes emigraron de la isla. La completa ausencia de mamíferos frugívoros terrestres (Dasypus, Agouti, Dasyprocta, Myoprocta, Nasua, Tapirus, Tayassu, Mazama y otros), que se encuentran temporalmente presentes en las tahuampas y bajiales de la tierra firme, deja el importante recurso alimentario, que son los frutos caídos al suelo del bosque, con abundancia, que son inaprovechados en las islas, salvo una pequeña parte que es consumida por marsupiales y ratones semiarbóreos por la noche. Entre los frutos que se desperdician en los bosques de las islas están grandes cantidades de frutos maduros de huito, charichuelo, tamamuri, capinurí, renaco y otros en estado de descomposición.
Los Primates
En la Isla de Iquitos se comprobó la presencia de poblaciones de primates de las especies Saimiri sciureus, Aotus sp. y Alouatta seniculus. En las otras islas censadas no se encontró primates. Esto concuerda con la información verbal de los lugareños, quienes aseguraron que nunca se vio monos en ellas. Sin embargo, no se pudo descartar la posibilidad de que Padre Isla tenga algunos Aotus viviendo en los bosques de las restingas interiores, ya que no se hicieron censos nocturnos. Una de las manadas observadas de Saimiri en la Isla de Iquitos (Manada NI' 19) aparentemente estaba compuesta en su totalidad por frailes del tipo arco romano (Soini 1972), correspondiendo sus características a Saimiri boliviensis (Hershkovitz 1984) más que a S. sciureus. Luego de las conversaciones con el Sr. Jaime Vidal, un exportador de monos, refirió haber soltado, por el año 1970, algunas remesas de frailes destinados a la exportación, procedentes de la cuenca del Río Ucayali, en la Isla de Iquitos.
Esto explica satisfactoriamente la presencia de la especie en la isla y también señala la posibilidad de que existan otras manadas de esta especie o manadas mixtas de las dos especies de Saimiri en la isla. Tampoco se puede descartar la posibilidad de que haya habido hibridación entre las dos especies. Las informaciones recopiladas de los lugareños, aseguran que la Isla de Iquitos fue anteriormente habitada por Cebus apella. Algunos opinan que aún podrían existir algunos ejemplares de esta especie en la isla, pero no se encontró indicios. Lo más probable es que ya fueron exterminados por los cazadores.
Probable origen de la población de primates en la Isla. Documentos de las misiones religiosas del siglo pasado, citados por Villarejo (1953) y Ramírez (1964), indican que aproximadamente hasta un siglo y medio atrás la actual Isla de Iquitos formaba parte de la margen izquierda o septentrional del Río Amazonas. Esto nos permite deducir que, exceptuando la población introducida de Saimiri boliviensis, la población de primates de la isla tiene una relación genética más cercana con la población de primates de la margen septentrional que con la de la margen meridional del Río Amazonas.
Saimiri sciureus. En 17 de los 35 encuentros con manadas de Saimiri (Cuadro 2) se lograron conteos aparentemente completos de los integrantes de las manadas, pero en 8 casos, es posible que hayan sido en mayor número. La manada más pequeña tenía 7 y la más grande 31 individuos; el tamaño promedio fue 14 individuos. Los conteos de individuos en manadas de tierra firme por otros investigadores (Neville et al. 1976, Freese 1975) reportan promedios de 20-50 y 40 individuos, respectivamente. Sin embargo, el tamaño pequeño de las manadas isleñas es probablemente un fenómeno real, ya que también Baldwin y Baldwin (1971) encontraron que Saimiri presentaba manadas más reducidas en los bosques de extensión limitada que en los bosques extensos. Los estudios posteriores probablemente demostrarán que el tamaño promedio de las manadas para la población de la isla es algo mayor de 14 individuos, pero para el presente cálculo de densidad poblacional utilizaremos este promedio.
Del total de 32 encuentros con Saimiri durante el censo, por lo menos 28 fueron encuentros con distintas manadas y 4 fueron posiblemente reencuentros con manadas ya censadas. Para el cálculo de densidad, utilizaremos el mínimo de encuentros únicos (28 manadas), lo que nos daría un promedio de 0,39 manadas por kilómetro de transecto para toda la isla. Empleando el sistema de cálculo de densidad desarrollado y aplicado por Freese (1975) en la tierra firme (campo auditivo visual de detección= 1 00m), conseguimos una estimación de la densidad cruda o general de 3,9 manadas o 54,6 individuos/ km'. Estas cifras no nos permiten estimar la población total de Saimiri en la isla, debido a que no se sabe qué porcentaje del área total de la isla presenta hábitat adecuado para Saimiri (posiblemente menos de 50% del área total). Las densidades obtenidas para las diferentes partes de la isla (Cuadro 3) se aproximan más a la densidad ecológica que a la densidad bruta, por el hecho de que los transectos fueron abiertos mayormente por terrenos frecuentados por Saimiri, como restingas y bajiales altos.
Cuadro 2.-Manadas de Saimiri encontradas en
la Isla de Iquitos
|
No. de Registro* |
Fecha |
Hora |
Tamaño |
Observaciones |
| 1 | 5.9.75 | 17.55 | Voces |
Fuera del censo |
| 2 | 7.9.75 | 12:40 | 7(+) |
Fuera del censo |
| 3 | 7.9.75 | 13:40 | 11 |
Fuera del censo |
| 4 | 8.9.75 | 8:45 | 7(+) |
Posiblemente la manada No. 2 |
| 5 | 8.9.75 | 09:50 | 2+ |
Probablemente la manada No. 3 |
| 6 | 8.9.75 | 14:10 | 2+ | |
| 7 | 8.9.75 | 14:32 | 15 | |
| 8 | 8.9.75 | 15:00 | 10 | |
| 9 | 8.9.75 | 15:43 | 4+ | |
| 10 | 13.9.75 | 08:25 |
Voces |
|
| 11 | 13.9.75 | 08:45 | 3+ |
Posiblemente miembros de la manada No. 12 |
| 12 | 13.9.75 | 09:30 | 11(+) | |
| 13 | 13.9.75 | 11:22 | 3+ | |
| 14 | 13.9.75 | 11:55 | 5+ | |
| 15 | 16.9.75 | 09:20 | 10+ | |
| 16 | 16.9.75 | 12:30 | 6+ | |
| 17 | 18.9.75 | 12:55 | 13 | |
| 18 | 19.9.75 | 09:20 | 17 | |
| 19 | 19.9.75 | 09:50 | 22 |
Todos "ucayalinos" |
| 20 | 19.9.75 | 1Q.45 | 20(+) |
Posiblemente "ucayalinos" |
| 21 | 19.9.75 | 12:15 | 13+ |
Posiblemente la manada No. 20 |
| 22 | 20.9.75 | 12:00 | 10(+) | |
| 23 | 20.9.75 | 13:10 | 9 |
Posiblemente la manada No. 22 |
| 24 | 20.9.75 | 13:50 | 31 | |
| 25 | 21.9.75 | 08:40 | 4 | |
| 26 | 21.9.75 | 09:15 | 2 | |
| 27 | 21.9.75 | 10:40 | 10+ | |
| 28 | 21.9.75 | 13:35 | 15(+) |
Posiblemente la manada No. 27. |
| 29 | 21.9.75 | 14:05 | 6+ | |
| 30 | 21.9.75 | 14:35 | 10+ | |
| 31 | 21.9.75 | 15.3 | 3+ | |
| 32 | 22.9.75 | 08:35 | 2+ | |
| 33 | 22.9.75 | 08:55 | 10(+) | |
| 34 | 22.9.75 | 09:45 | 18 | |
| 35 | 22.9.75 | 11:15 | 5+ |
+ = Conteo, incompleto
+) = Conteo posiblemente incompleto
+ = Las ubicaciones aproximadas de las manadas están
indicadas en Fig. 2
Cuadro 3.- Resultados del censo de Saimiri
sciureus en Isla de Iquitos
|
Fecha |
Tiempo cen sado (horas) |
Distancia censada(m) |
Manadas encontradas |
Densidad | ||
|
Zona Norte |
08.9.75 | 09:10 | 12 397 | 6 | ||
|
13.9.75 |
8 |
11 319 |
4 |
|||
|
21.9.75 |
09:40 |
11 187 |
6 |
|||
|
22.9.75 |
435 |
4656 |
4 |
|||
| 31:25:00 | 39559 | 20 | 5,0 | 70,0 | ||
|
Zona Central |
14.9.75 |
Feb-40 |
3797 |
0 |
||
|
15.9.75 |
05:25 |
4672 |
0 |
|||
|
16.9.75 |
06:50 |
4683 |
2 |
|||
|
18.9.75 |
04:20 |
4211 |
1 |
|||
| 19:15 | 17363 | 3 | 1,7 | 23,8 | ||
|
Zona Sur |
10.9.75 |
Jul-43 |
9 194 |
3 |
||
|
20.9.75 |
03:25 |
2570 |
2 |
|||
|
28.9.75 |
02:50 |
3780 |
0 |
|||
|
13:58 |
15 544 |
5 |
3,2 |
44,8 |
||
|
Toda la isla |
64:38:00 |
72466 |
28 |
319 |
54,6 |
|
* Campo auditivo-visual de detección = 100m; man./km2 = manadas/km2; ind./km2 = individuos/kmI.
Aunque los datos obtenidos no nos indican el número
total de manadas o individuos en la isla, nos permiten comparar entre sí
las densidades encontradas en las diferentes partes de la isla. En base a las
frecuencias de encuentros con manadas de Saimiri (Fig.2) podemos dividir la
isla en tres zonas distintas, de acuerdo con las densidades poblacionales que
presentan.
1. Zona Norte:
Desde el extremo septentrional hasta la laguna grande situada aprox. 1 km al Norte del Caserío Santa Martha (Zona 2). Area total: 34 km2.
2. Zona Central:
Desde el limite de la Zona Norte hasta el Caserío Progreso. Area total: 9,3 km2.
3. Zona Sur:
Desde el límite de la Zona Central hasta el extremo meridional de la isla. Area total: 9,2 km2.
Aotus sp.
En el transcurso del estudio se ubicaron 7 unidades de Aotus dentro de un área no mayor de 4 km2 en la Zona Norte (Fig. 3). Cuatro fueron ubicados en sus respectivos nidos y 3 durante un breve censo nocturno. El resultado del censo nocturno fue de 1,5 grupos por kilómetro de camino. Aunque esto sugiere una elevada densidad de Aotus en el área, los datos obtenidos son insuficientes para una estimación razonable de densidad. Los grupos observados eran de 3 a 4 individuos, con un promedio de 3,2 individuos por grupo y el modo, 3 individuos por grupo (Cuadro 4). Según observaciones de Moynihan (1964), los grupos de Aotus consisten generalmente de una pareja con o sin una cría, lo que concuerda con nuestras observaciones personales, aunque a veces se detectan grupos de hasta 6 individuos.
Según información de los lugareños y constatación personal, la capirona (Calycophyllum spruceanum) es la especie de árbol utilizado por Aotus con mayor frecuencia como árbol de nido. Esto se debe aparentemente al hecho de que entre los árboles grandes que se encuentran en la isla, éste presenta el mayor número de huecos adecuados para el retiro diurno. Por la misma razón, también las colmenas de abejas se encuentran con mayor frecuencia en estos árboles, los que son talados en gran número para extraer la miel.
Cuadro 4.- Grupos de Aotus encontrados en la
Isla de Iquitos
|
No. de Registro* |
Fecha |
Hora |
Tamaño grupo |
Observaciones |
| 1 | 5.9.75 | 14:30 | 3 |
En hueco de capirona a 25 m altura |
| 2 | *9.75 | 13:35 | 3 |
En hueco de capirona a 22 m altura |
| 3 | 22.9.75 | 08:00 | 1 |
En hueco de capinurí a 20 m altura |
| 4 | 22.9.75 | 10:35 | 3 |
En hueco de ojé a 12m altura |
| 5 | 22.9.75 | 21:00 | 3 |
Censo nocturno |
| 6 | 22.9.75 | 21:15 | 4 |
Censo nocturno |
| 7 | 22.9.75 | 21:30 | IM |
Vocalización de un musmuqui durante censo nocturno |
*Las ubicaciones aproximadas de los grupos están indicadas en Fig.3.
Alouatta seniculus.
A pesar de las afirmaciones de los lugareños sobre la existencia de Alouatta, no se logró observar ninguna manada. Sin embargo, esto no excluye la posibilidad de que en la isla todavía se encuentre por lo menos un grupo reducido de esta especie, ya que en presencia del hombre, Alouatta se esconde en las copas más densas de los árboles mayores en las regiones donde es perseguido por cazadores. Todavía, en el mes de Mayo del presente año, varios lugareños escucharon vocalización de Alouatta en un área céntrica en la Zona Norte (Fig. 3). Por la información de los lugareños de distintas partes de la isla, se sabe que Alouatta abarcaba toda la isla. Personas radicadas en la Zona Sur comentaban la existencia de muchos cotos en años pasados y su conducta de respuesta con vocalizaciones al ruido de los aviones. La exterminación de Alouatta en la isla se debe exclusivamente a la caza, porque los bosques existentes presentan un hábitat completamente adecuado para la especie.
El Ronsoco (Hydrochoerus hydrochaeris)
Encontramos indicios de por lo menos 19 grupos de ronsocos en la isla principal, 2 en la Isla Padre Isla y uno en la Isla Padre Cocha. La especie está distribuida por todo el largo de la isla principal e indudablemente existen muchos grupos más. La mayor densidad de huellas y "caminos" del ronsoco observados corresponde a la Zona Central (Fig. 3). El ronsoco pasa el día escondido en los fangales y rayabalsales más inaccesibles de los bajiales y las orillas de las lagunas. Sale de noche para alimentarse, ocasionando considerables perjuicios en los arrozales y maizales en las islas, porque consumen hojas y tallos tiernos. Donde son abundantes, forman caminos regulares y se puede observar en verano cuando en las lagunas, hacen pozas o "bañaderos".
Los Quelonios
La revisión de las playas e información proporcionada por los lugareños revelaron que en las islas estudiadas hay un total de siete playas utilizadas para el desove anual por taricaya (Podocnemis unifilis) y cupiso (P. sextuberculata). La charapa (P. expansa) no sube a las playas de estas islas. La temporada anual de desove empieza en la segunda mitad de Julio y termina al comienzo de Octubre, con el máximo de desoves en Agosto y comienzos de Setiembre. El período de incubación de los huevos es normalmente de 2,5 a 3 meses. La taricaya vive en las cochas y pozos de las islas, de donde emigra al río para subir a las playas a desovar, salvo algunas hembras que ocasionalmente depositan sus huevos en la orilla de la laguna donde vive. Durante el aumento del nivel del agua viven en los bosques inundados. El cupiso no habita las lagunas interiores, sino permanece mayormente en las aguas de los rí
os y canales. El desove se realiza de noche.
Descripción y censo de las playas de desove.
La Isla de Iquitos tiene sólo una playa tortuguera (Playa "A"), situada en el extremo nor-oriental (Fig. 3). La playa tiene una longitud de 3 km aproximadamente, con un ancho máximo de 400 m. La playa fue censada por toda su extensión en dos oportunidades (14 y 17 Set.75) pero no se encontró huellas de quelonios. Sin embargo, una de las dos familias que viven en el extremo interior de la playa, nos informó que durante todo el mes de Agosto subieron muchas taricayas y cupisos, mientras que en Setiembre subieron muy pocos. Padre Isla tiene tres playas tortugueras (Fig. 3): Playa "B" tiene una longitud de casi 2 km, con un ancho máximo de 400 m. Fue censada en tres oportunidades (14, 15 y 17 Set.75) y se encontró las huellas de una taricaya que había subido 2 veces, pero regresó al agua sin desovar, y de un cupiso que subió y desovó posiblemente en la noche del 14 o 15 Set.75.
Los lugareños nos informaron sobre sus
"cosechas" en esta playa, como sigue:
| - | 26.8.75 | encontraron un nido de cupiso con 18 huevos | |||
| - | 7.9.75 | encontraron un nido de cupiso con 16 huevos | |||
| - | . 8.9.75 | encontraron un nido de cupiso con 18 huevos | |||
| - | . 10.9.75 | encontraron un nido de cupiso con 11 huevos | |||
| - | . 7.9.75 | encontraron también 2 taricayas, pero no desovaron. | |||
Playa "D" tiene una longitud de 1 km aproximadamente, con un ancho máximo de unos 100 m. Fue censada el 22 Set.75 y encontré huellas de un cupiso que desovó y regresó al río. El nido fue posteriormente saqueado. Según información de los habitantes, 6 taricayas subieron a esta playa en la noche de 29/30 Ago.75. Todas fueron capturadas y consumidas. Playa "E" tiene una longitud de 1,5 km aproximadamente, con un ancho máximo de 50 m. Fue censada el 22 Set.75, pero no se encontró huellas de quelonios. Los lugareños informaron que en Agosto subieron taricayas y cupisos.
La Isla Padre Cocha tiene una playa tortuguera (Playa "C"), situada en el extremo oriental de la isla, con una longitud de 600 m y ancho de 100 m aproximadamente. Fue censada en dos oportunidades (14 y 16 Set.75) y se encontró huellas de 2 cupisos, de los cuales uno regresó al río sin desovar y otro desovó; el nido fue posteriormente saqueado. También subió una taricaya, desovó y regresó al río; el nido fue posteriomente saqueado. Según información proporcionada por la familia que vive en un extremo de la playa, sólo vieron este año 8 taricayas y 6 cupisos (indudablemente esto se refiere al número de ejemplares recogidos por ellos).
La Isla Buenos Aires tiene una playa grande que se extiende por todo lo largo de la orilla occidental, con una Iongitud de 3,5 km aproximadamente y un ancho máximo de 0,5 km. El 20 Set.75 se revisó 2262 m de orilla de playa, pero no se encontró huellas de tortugas. Sin embargo, los habitantes de los Caseríos Padre Cocha y de Padre Isla la conocen como una buena playa tortuguera, y una familia informó que en Agosto ellos cogieron en una mañana, 800 huevos de taricaya y cupiso.
De los resultados del censo de playas, podemos deducir que (i) la temporada de mayor desove para taricaya y cupiso ya había pasado, (ii) muchas de las hembras que suben a las playas de las islas a desovar son capturadas y (iii) virtualmente todos los nidos son saqueados por la gente.
Los Lagartos
"Única especie de lagarto que se encontró en las islas fue Caiman crocodilus. Sin embargo, los lugareños afirmaron que también existe el Melanosuchus niger, por lo menos en la isla principal, y probablemente también en Padre Isla. Como se pudo observar, ambas islas presentan, abundantemente, hábitat adecuado para Melanosuchus. C. crocodilus habita las lagunas y canales interiores de toda la isla principal, Padre Isla e Isla Padre Cocha. Cuando las lagunas se secan (aunque no todas),los lagartos pasan los días enterrados en el fango, con sólo las narices expuestas. Se observó sólo 6 ejemplares (4 en Isla de Iquitos y 2 en Padre Isla), de los cuales 3 fueron capturados, examinados y luego soltados. El ejemplar mayor medía 1,42 m, fue hembra y, juzgando por la forma, estaba con huevos.
Aprovechamiento actual de la fauna
El recurso animal principal para los pobladores de las islas es el pescado, que existe en grandes concentraciones en las aguas litorales, lagunas y canales interiores, particularmente en la época de estiaje (julio-Octubre). Durante esta época se observó que grandes cantidades de peces mueren cuando las pozas, lagunas y canales se secan . Padre Isla parece tener paiches (Arapaima gigas), ya que durante nuestra estadía allí pescaron un ejemplar en Pastor Cocha. Aparte de la pesca para alimentación, algunos pobladores se dedican a la pesca de peces ornamentales en las lagunas y canales para la exportación vía Iquitos. Los principales animales silvestres consumidos en las islas, son:
- Mamíferos:
Musmuqui (Aotus sp.)
Fraile (Saimiri sciureus)
Shihui (Tamandua tetradactyla)
Ratón o Sachacuy (mayormente Proechimys spp.)
Zorro (Didelphis marsupialis)
Ronsoco (Hydrochoerus hydrochaeris)
Cashacushillo (Coendou bicolor)
Chosna (Potos flavus)
Vaca marina (Trichechus inunguis)
- Aves:
Panguana (Crypturellus undulatus)Manacaracuy (Ortalis guttata)
Garzas (Ardeidae)
Palomas (Columbidae)
Coro-coro (Mesembrinibis cayennensis)
Loros (Psittaciformes)
- Reptiles:
Motelo (Geochelone denticulata)
Taricaya (Podocnemis unifilis)
Cupiso (Podocnemis sextuberculata)
Lagarto blanco (Caiman crocodilus)
- Invertebrados:
Churos (Pomacea sp., Gastropoda)Conchas (Pelecypoda)
Miel de abeja
El musmuqui es exclusivamente nocturno y pasa el día en huecos de árboles. Delata su presencia al cazador por la costumbre de asomar la cabeza por el agujero de su nido cuando alguien pasa cerca de su árbol de residencia. Al golpear fuertemente al tronco del árbol donde reside el animal o todo el grupo, sale generalmente a sentarse sobre las ramas, convirtiéndose en fácil blanco del cazador. También pueden ser cazados de noche con linterna y escopeta.
Las manadas de frailes son fáciles de ubicar por el cazador; por los ruidos y las vocalizaciones, son cazados de día con escopeta.
El ronsoco es principalmente nocturno y es cazado mayormente con linterna y escopeta, o con ayuda de perro(s) adiestrados(s) en el día. Su carne no parece ser muy apreciada y muchas veces son perseguidos por los daños que ocasionan a los cultivos de arroz y maíz.
Los ratones o sachacuyes son mayormente nocturnos y su carne es apreciada por los lugareños que los cazan con trampas de palo en las purmas y chacras.
La chosna es arbórea y nocturna. Su carne es muy apreciada y la caza se hace de noche con linterna y escopeta. El shihui y el cashacushillo (el primero es semiarbóreo y el segundo arbóreo) son cazados de día y de noche, con escopeta. El zorro y, más raramente los otros marsupiales, son ocasionalmente matados para el consumo, aunque generalmente no se les caza, pero cuando la oportunidad se presenta, son sacrificados a machetazos.
La carne y manteca de la vaca marina son muy apreciadas, pero su existencia parece ser rara. Se observó el cráneo de un ejemplar cazado en Padre Isla durante la inundación del año 1974.
Las aves son cazadas principalmente de día con escopeta. Los huevos de varias especies de aves son recolectados para consumo.
En la temporada de desove de la taricaya y del cupiso (julio-Octubre) las hembras son sorprendidas y recogidas de noche en las playas donde suben a desovar. También, los huevos que ponen son recogidos para el consumo y parece que sólo un pequeño porcentaje de los huevos puestos no son encontrados. Por información, se sabe que hay motelos en las restingas y bajiales de la isla principal. Su carne es muy apreciada.
La carne del lagarto blanco, particularmente de los ejemplares juveniles es apreciada por muchos habitantes. Cuando las lagunas están secas y los lagartos permanecen enterrados en el fango, un hábil cazador puede ubicar al animal de día sondeando en el fango con un palo o machete y matarlo. Cuando las lagunas están con agua se les caza con escopeta, arpón o machete desde una canoa por la noche, con ayuda de una linterna. Los churos se cosechan en grandes cantidades cuando los charcos y quebraditas se llenan.de agua clara de las primeras lluvias de invierno y cuando bajan las aguas.
La extracción de miel de abejas silvestres representa una fuente de ingresos considerable para algunas personas en la isla principal. Se encontró abundancia de colmenas de estas abejas, mayormente en huecos de árboles grandes, a considerables alturas y con mayor frecuencia en las capironas (Calycophyllum spruceanum). Para extraer la miel cortan el árbol. La madera queda generalmente inaprovechada. Una colmena puede proporcionar hasta 9300 cc a más (15 botellas a más). La tala de árboles para otros fines es también común. Durante los estudios en las islas, el tamamuri (0gcodeia tamamuri) y charichuelo (Rheedia macrophylla) se encontraban en plena temporada de fructificación, y fueron talados en los bosques de la isla principal con el fin de obtener frutos, para ser vendidos en el mercado de Iquitos. Cabe mencionar que estos frutos son también consumidos por Saimiri y, probablemente, Aotus.
Conclusión sobre el aprovechamiento de la fauna
Exceptuando los peces, la fauna de las islas no representa un recurso alimentario de primera importancia para la población humana de las islas. Aparte de la pesca, sólo los quelonios y sus huevos, y la miel de abejas están sujetos a una explotación intensiva. Sin embargo, en el invierno, cuando el río crece y los peces escasean, la caza de animales silvestres para consumo se hace más intensa.
Daños causados a la agricultura por la fauna silvestre
El ronsoco hace incursiones nocturnas a los sembríos de arroz y maíz, comiéndose los tallos y dejando sólo la parte más inferior de las plántulas. Este daño a veces excede a áreas de 300 m'.
Una especie de ratón, llamado por algunos lugareños "ratón bayano" (Holochilus brasiliensis ?), vive en los arrozales playeros. Se alimenta de las plántulas del arroz y, donde abunda, puede causar considerables estragos.
Las aves mayormente Passeriformes, invaden los arrozales en bandadas, causando considerables pérdidas. La Iguana iguana invade los sembríos de sandía para alimentarse de las hojas y tallos tiernos de estas plantas. No se pudo constatar si los daños causados por este animal eran considerables o no.
CONCLUSIONES GENERALES
La Isla de Iquitos presenta una macrofauna rica en especies y número de animales, destacando las siguientes especies por su importancia para un futuro manejo: Aotus sp., Saimiri sciureus, Hydrochoerus hydrochaeris, Trichechus inunguis, Podocnemis sextuberculata, Podocnemis unifilis, Caiman crocodilus y, posiblemente, Melanosuchus niger. La fauna primatológica de la Isla de Iquitos incluye 3 especies, de las cuales Aotus sp. y Saimiri sciureus existen en considerable abundancia, con la mayor densidad poblacional en la Zona Norte de la isla. Las otras islas no contienen poblaciones de primates.
La Isla de Iquitos tiene una abundante población de Hydrochoerus hydrochaeris, encontrándose la especie también en las islas Padre Isla y Padre Cocha Las islas tienen 7 playas tortugueras donde suben a desovar anualmente Podocnemis sextuberculata y Podocnemis unifilis. La temporada de desove empieza en Julio y termina en Octubre. Las hembras que suben a desovar son a menudo capturadas y virtualmente todos los huevos depositados en las playas son consumidos por la gente. Las lagunas tienen una población abundante de Caiman crocodilus. Aparentemente Melanosuchus niger también existe. La fauna silvestre, salvo los peces, no representa una fuente alimenticia de primera importancia para los habitantes.
RECOMENDACIONES ACERCA DEL MANEJO DE LA FAUNA DE LAS ISLAS
Por la urgente necesidad de establecer áreas para estudio, conservación, manejo y eventual aprovechamiento controlado de especies de primates y de otra fauna, y considerando que las islas estudiadas reúnen las condiciones necesarias para ello, se recomienda lo siguiente:
1. Que la Zona Norte de la Isla de Iquitos, Padre Isla e Isla Padre Cocha sea convertida en una Reserva Biológica.
justificaciones: La Zona Norte tiene buenas densidades poblacionales de Saimiri y Aotus, que podrían ser manejadas y de las cuales se podría cosechar periódicamente un número determinado de ejemplares para exportación. El número de ejemplares que se cosecharía debería fijarse de acuerdo con la tasa de productividad de estas poblaciones. Tiene la mayor extensión de bosque natural y deshabitado, hábitat adecuado para las mencionadas especies; además tiene una buena población de Hydrochoerus hydrochaeris y una playa extensa, utilizada por P. unifilis y P. sextuberculata para el desove anual.
Padre Isla reúne las mejores condiciones para introducción experimental de Saguinus mystax, por tener i) dos restingas altas, de mínima inundación, con bosque apropiado; (ii) no está actualmente habitada por Saimiri u otros primates que pudieran competir directamente por los recursos naturales con la especie introducida; (iii) el área está convenientemente delimitada por barreras naturales (lagunas y las orillas), que le permiten mantener un control de las poblaciones introducidas. Tiene 3 playas utilizadas por P. unifilis y P. sextuberculata para el desove anual, y está poblada por H. hydrochaeris, C. crocodilus y, probablemente M. niger.
La Isla Padre Cocha tiene una restinga y bajial alto con bosques adecuados para introducción experimental de una o dos manadas de Saimiri y Aotus. El bosque es suficientemente reducido y delimitado para permitir constante observación y control de los animales introducidos. Está separado de la isla principal por un canal de 10 a 20 m de ancho. Tiene una playa donde P. unifilis y P. sextuberculata suben a desovar. Se encuentra habitada por sólo 2 ó 3 familias, que no viven todo el año.
2. Que se prohiba la caza y la tala de árboles en estas áreas.
3. Que las playas de desove de P. unifilis y P. sextuberculata sean vigiladas durante los meses de desove e incubación (desde julio hasta Enero).
4. Que se determine el tamaño de las poblaciones de Saimiri y Aotus existentes en la Zona Norte de la Isla de Iquitos, la composición de las manadas y la tasa anual de reproducción.
justificaciones: Sólo a base de estos datos se podría definir el número, sexo y edad de los animales que se podría cosechar, anualmente sin afectar el nivel actual de las poblaciones.
En vista que Saimiri tiene una temporada fija de' nacimientos, desde fines de Diciembre hasta Marzo, sería factible obtener la tasa de reproducción deter- minando el total de individuos existentes ahora y, de nuevo, después de la temporada de nacimientos. Se desconoce si Aotus presenta una temporada definida de nacimientos.
5. Que se introduzca una manada de Saimiri y una manada de Aotus familia) en la Isla Padre Cocha.
Justificaciones: Según las observaciones, la isla no tiene actualmente primates y consiste en un área aislada y reducida, esto nos brinda la oportunidad de experimentar y observar bajo condiciones controlables el desenvolvimiento de las manadas e individuos (marcados con señales visibles) en el nuevo ambiente, lo que podría aportar datos importantes para manejo en otras áreas.
6. Que se introduzca una población de Saguinus mystax y una de Aotus en Padre Isla. Ñ
justificaciones: Padre Isla no tiene actualmente primates, pero la parte interior parece presentar un hábitat adecuado para ellos. No conocemos todavía los requerimientos ambientales de S. mystax, pero tratándose de una de las especies más importantes para el manejo, es necesario hacer una introducción experimental. No se recomienda introducir otras especies, para evitar cualquier competencia sobre los recursos alimenticios, sino brindar a la población introducida las óptimas condiciones ambientales, excepto Aotus, que es nocturno.
Las manadas de S. mystax están formadas básicamente por una pareja adulta y sus descendientes, hasta un total de 6 individuos (Castro y Soini 1977); se recomienda introducir grupos completos. Las mejores áreas para la introducción serían las dos restingas largas y más elevadas que bordean a Pastor Cocha (Fig. 4). Estimo que, para empezar, se podría soltar unas 3 manadas en ambas restingas. De Aotus se podría introducir unos 5 a 10 grupos en diferentes partes de la Isla.
7. Establecer una pequeña estación biológica en Padre Isla.
justificaciones: Para la continuación de los estudios ecológicos y faunísticos es necesario contar con una pequeña casa con facilidades para dormir, trabajar y cocinar. El lugar ideal para la estación sería la restinga que forma el istmo entre Barbón Cocha y Pastor Cocha (Fig. 4). Es el sitio que menos se inunda y que mayor control permite sobre el área de estudio e introducción de S. mystax. Está alejado de las poblaciones humanas en el interior de la isla y, sin embargo, permite una rápida comunicación con ambos extremos de la isla por tierra y por agua.
8. Que se realicen estudios sobre la distribución, abundancia y reproducción de H. hydrochaeris, Trichechus inunguis, C. crocodilus y Melanosuchus niger para la planificación de su futuro manejo en las islas.
AGRADECIMIENTOS
Deseo agradecer a los siguientes expertos y amigos por la colaboración que me brindaron en el cumplimiento del presente estudio: Profesor Guillermo Cetraro (UNAP), quien ayudó en la identificación exacta de algunas especies de aves; Dr. José López Parodi, quien revisó el mapa básico de las islas, utilizado en el estudio; Dr. Sydney McDanieis, quien ayudó en la identificación de algunos especímenes botánicos coleccionados en las islas; y Dr. James R. Dixon, quien identificó varias especies de anfibios colectados en la Isla de Iquitos.
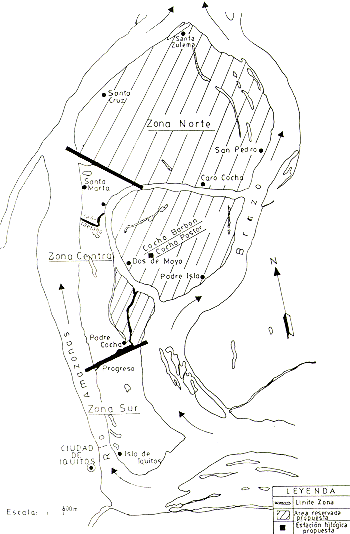
Fig. 4.- La zonificación propuesta de las islas.
REFERENCIAS
Baldwin, J.D. y J.1. Baldwin. 1971. Squirrel monkeys (Saimiri) in natural habitats in Panama, Colombia, Brazil and Perú. Primates 12l 45-61.
Castro, R. y P. Soini. 1977. Field studies en Saguinus mystax and other Callitrichids in Amazonian Peru. pp. 73-78. En D.G. Kleiman (Ed.). The Biology and Conservation of the Callitrichidae. Smithsonian Inst. Press, Washington, D.C.
Freese, C. 1975. Final Report: A census of non-human primates in Peru. Pan American Health Organization, Project AMRO-0719.
Hershkovitz, P. 1984. Taxonomy of squirrel monkeys genus Saimiri (Cebidae, Platyrrihini): A preliminary report with description of a hitherto unnamed form. Amer. 1. Primatol. 7: 155-210.
Moynihan, M. 1964. Some behavior patterns of Platyrrhine monkeys. 1. The nigth monkey (Aotus trivirgatus). Smithsonian Misc. Coll. 146: 1-84.
Neville, M., N. Castro, A. Mármol y J. Revilla. 1976. Censusing primate populations in the reserved area of the Pacaya and Samiria rivers. Department Loreto, Peru. Primates 17(2): 151-181.
Ramírez, J. 1964. Monografía del Departamento de Loreto. Edición privada. Iquitos. 94 pp.
Soini, 11. 1972. The capture and commerce of live monkeys in the Amazonian region of Peru. Int. Zoo Yearb. 12: 26-36.
l t Villarejos, A. 1953. Así es
la Selva. Estudio monográfico de la Amazonía Nor Oriental del
Perú. Sanmarti y Cia, Lima (2da. edición). 307 pp.
RESULTADOS DE UN ESTUDIO PRIMATOLOGICO EN LA ZONA NORTE DE LA ISLA DE IQUITOS*
(* Informe presentado al Ministerio de Agricultura-Perú
en Mayo de 1976).
Pekka Soini y Luis Moya
INTRODUCCIÓN
Desde Octubre 1975 hasta Abril 1976 se realizó un estudio ecológico de la población de primates existentes en la Zona Norte de la Isla de Iquitos. Los objetivos principales del estudio fueron: 1) determinar la densidad poblacional y estimar el tamaño de la población total de Saimiri sciureus; 2) obtener datos ecológicos y demográficos para el manejo y conservación de la población isleña, 3) desarrollar un método adecuado de censo para Aotus nancymai, a fin de estimar la densidad poblacional y, 4) obtener información para la conservación y manejo de la fauna.
MÉTODOS
El área de estudio fue dividida en cuatro bloques, cuyas extensiones oscilaban de 2 a 5 km2 aproximadamente. Los cursos de los caños y cochas (lagos) anchas y largas servían de límites naturales para la dispersión de las manadas de monos en el interior de la isla. Cada uno de estos bloques fueron sometidos a estudios por un período que varió de una semana a 3 meses. Dentro de cada bloque, las actividades fueron realizadas en tres etapas principales.
1ra. etapa: Exploración y reconocimiento del área, fijación de los límites geográficos, y trazamientos de la red de transectos a construirse.
2da. etapa: Construcción y medición de los transectos (trochas, aproximadamente rectas y paralelas) y levantamiento de un mapa en detalle.
3ra. etapa: Caracterización ecológica del área, localización y observación intensiva de todas las manadas de Saimiri sciureus y algunas manadas de Aotus nancymai, identificación de los vertebrados existentes (excepto peces), observaciones sobre fructificación y colecta de muestras botánicas.
Para llevar a cabo el ploteo, conteo y otros estudios de los primates, fue necesario construir, medir y graficar un total de 49 km de transectos. En algunos casos, utilizamos trochas ya existentes, algunas de ellas hubo que reabrirlas. Debido a las limitaciones de apoyo auxiliar y financiero, la mayor parte de los transectos tuvieron que ser preparados invirtiendo unas 1135 horas, es decir un 13% de nuestro tiempo total dedicado al trabajo de campo.
La ubicación de las manadas de Saimiri y el delineamiento de sus áreas domiciliarias, se realizaron mediante:
1. Censos simultáneos repetidos por dos o tres transectos paralelos, cuya mutua distancia oscilaba entre 50 y 250 m.
2. Ubicaciones sucesivas repetidas de manadas adyacentes.
3. Seguimiento extendido de los movimientos de las manadas.
Debido a la gran movilidad y timidez de las manadas de Saimiri, virtualmente fue imposible obtener conteos fidedignos del número total de individuos dentro de la manada, durante sus actividades diurnas. Mejores resultados fueron obtenidos por conteos efectuados en la madrugada, un poco antes o en el instante que la manada abandonaba su árbol de dormir. En vista que las manadas no dormían dos noches sucesivas en un mismo árbol, éste tenía que ser localizado el día anterior mediante seguimiento de la manada. Para obtener un conteo satisfactorio fue necesario repetir la operación por tres o más días.
En cada encuentro con una manada, la ubicación exacta de ésta fue determinada en relación al punto en que se encontraba el observador en el transecto. El observador mantenía constante registro de su ubicación mediante el contómetro y pasos calibrados. La ubicación de los encuentros y los movimientos subsecuentes de las manadas fueron proyectados diariamente en el mapa matriz.
Para los censos y observaciones nocturnas de Aotus, utilizamos los mismos transectos y métodos de ubicación y registro. Los procedimientos adoptados para los censos nocturnos están descritos con mayor detalle más adelante. Para la ubicación de los árboles de retiro diurno de Aotus, contamos en algunos casos, con la ayuda de lugareños que accidentalmente habían encontrado madrigueras o "nidos" de Aotus; otros fueron localizados siguiendo la manada en la madrugada hasta su madriguera.
DESCRIPCIÓN DEL ÁREA DE ESTUDIO
El área de estudio consiste en 12 km2 de terreno continuo en el extremo septentrional de la Isla de Iquitos (Fig. l).Esta isla se encuentra ubicada en el Río Amazonas, frente a la Ciudad de Iquitos, Departamento de Loreto. La longitud máxima es de 18 km y una superficie de 53 km2. Gran parte de la isla está sujeta a inundación anual por la creciente estacional del Río Amazonas que alcanza su máximo nivel desde Abril a junio. Una descripción mas amplia de las islas adyacentes fue presentada en un informe anterior (Soini, este volumen).
El área de estudio fue dividida en tres zonas principales basadas en el tipo predominante de vegetación (Fig. 2) :
Terrenos de reciente formación (menos de 50 años
de edad». Esta zona comprende extensos gramalotales y, bijauales y
bosques sucesionales de reciente formación, mayormente sujetos a
profundas inundaciones. La vegetación está constituida por
pocas especies, predominando Paspalum spp., Heliconia spp., Bombax aquaticum,
Cecropia spp. Erythrina sp., y Ficus spp. La extensión aproximada
es de 1,0 km2 o sea 8% del área total.
Terrenos más maduros (50 años de edad o más)
con bosques heterogéneos. El terreno está rayado de largas
cochas y caños paralelos, intercalados con restingas altas y bajas,
sujetos o no a la inundación anual según su elevación
y magnitud de la creciente. No existen especies predominantes, pero se observan
manchales de vegetación más homogénea. La extensión
aproximada de esta zona es 8,4 km2 o 70% del área total.
Terrenos despejados por el hombre. Comprende una faja litoral
de unos 400 m de ancho, que se encuentra en permanente ocupación
por los habitantes. La vegetación consiste en plantas cultivadas
y vegetación secundaria completamente degenerada. La extensión
aproximada de esta zona es 2,5 km' o 22% de la superficie total.
RESULTADOS
Saimiri sciureus
Fue el principal objetivo y más del 80% del tiempo fue dedicado al estudio de esta especie. Las observaciones directas de manadas empezaron en Octubre 1975 y terminaron en Abril 1976. El fraccionamiento y aislamiento gradual de las áreas domiciliarias de las manadas por la inundación estacional del interior de la isla, imposibilitó continuar los estudios después de dicha fecha.
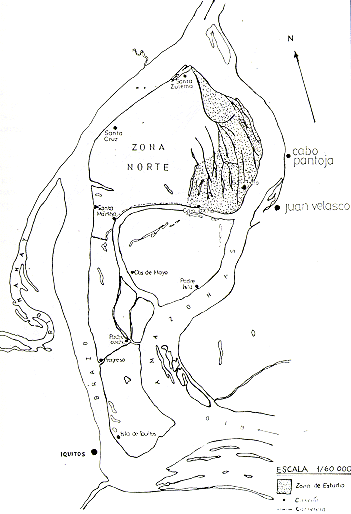
Fig.1.- Mapa de la Isla de Iquitos
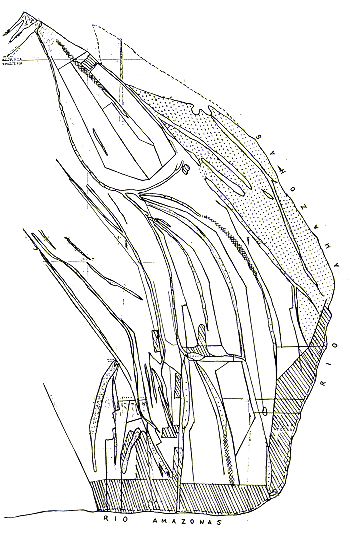
Fig. 2. - Zonificación ecológica del área
de estudio en Zona Norte,
Isla de Iquitos
El número total de manadas fue 21 (numeradas del 1 al 21). En dos casos, no pudimos determinar si se trataba de dos o una manada, lo que fue tomado en cuenta cuando determinamos la densidad en el área. Grupos de Saimiri fueron observados en 214 diferentes oportunidades y el tiempo de contacto con los animales por observación osciló de pocos minutos a un día entero.
Hábitat.
El hábitat de Saimiri en la isla consiste en bosque primario y/o secundario heterogéneo. Los bosques sucesionales dominados por Cecropia sp., Erythrina sp., Bombax sp., o asociaciones de estas especies, aparentemente no presentan la diversidad ambiental que garanticen una fuente continua de recursos alimentarios durante todo el año, y salvo incursiones marginales, no contienen poblaciones de Saimiri.Las orillas e inmediaciones de las cochas y canos son las áreas de mayor uso y, por consiguiente, de mayor importancia para Saimiri (Fig. 3). Así, por ejemplo, encontramos una correlación positiva entre la distribución de las manadas (consecuente densidad poblacional local) y la cantidad de orillas de vegetación heterogénea dentro del área de estudio.
Tamaño y composición de las manadas. De las 21 manadas observadas, probablemente en 16 se logró conteos completos, tal como podemos observar a continuación (cifras en paréntesis indican menos confiabilidad .
|
Manada N° |
Individuos |
Crías nacidas | |
|
Durante el estudio |
Total |
||
| 1 | (19) | ||
| 3 | (26) | ||
| 4 | (18) | ||
| 5 | (33) | ||
| 6 | (18) | ||
| 7 | (30) | ||
| 9 | 14 | ||
| 10 | (14) | ||
| 11 | 18 | ||
| 12 | 20 | ||
| 13 | (12) | ||
| 14 | 18 | 3 | 21 |
| 15 | 24 | 5 | 29 |
| 16 | 23 | 4 | 27 |
| 17 | 16 | 3 | 19 |
| 18 | 15 | 3 | 18 |
| X = 20 | 4 | 24 | |
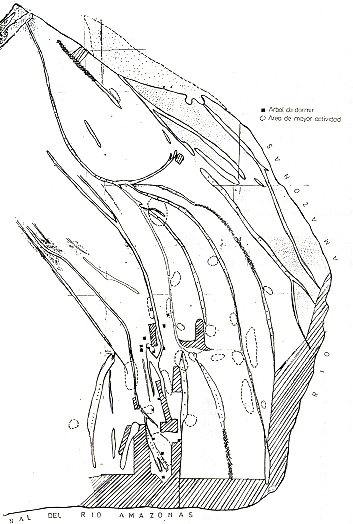
Fig. 3.- Lugares de mayor actividad de las
manadas de Saimiri sciureus en el área de estudio
En una oportunidad se obtuvo un conteo de 45 individuos dentro del área domiciliaria de la manada Nº 7, pero este conteo posiblemente incluía miembros de la manada adyacente (Nº 8), por lo tanto requiere confirmación. Los resultados nos permiten estimar en 20 animales de locomoción propia como el tamaño promedio de las manadas.
Cinco manadas fueron estudiadas en detalle para determinar su composición aproximada. Los miembros de las manadas fueron clasificados en tres categorías, basadas en el desarrollo físico y comportamiento: machos adultos, hembras adultas y juveniles de ambos sexos. Posteriormente, se agregó la categoría de crías. Por la naturaleza del estudio no fue posible la clasificación de los juveniles por sexo y edad, sino se les incluyó dentro de esta categoría a todos los miembros no reproductivos de la manada, desde las crías del año anterior hasta los subadultos. Las manadas tenían la siguiente composición:
Machos adultos. Se observó de 2 a 3 machos por manada, comprendiendo el 9,13% de la población.
Hembras adultas. Se observó de 2 a 6 hembras por manada, constituyendo el 16 a 27% de la población. Es posible que algunos de los clasificados como subadultos en realidad sean hembras adultas.
juveniles. El número de juveniles y subadultos oscilaba entre 9 y 15 aproximadamente, comprendiendo entre el 14 a 17% de la población.
Crías del año. El número de crías nacidas durante el estudio fue de 3 a 5 por manada, comprendiendo entre el 14 a 17% de la población.
El tamaño y composición de las manadas sufren fluctuaciones temporales en sincronía con las fases estacionales de reproducción. Las manadas alcanzan su máximo al final de la temporada de crías a fines de Marzo; de allí van disminuyendo por mortalidad, y llegan a su mínimo nivel en Enero, que es el comienzo de la siguiente temporada de cría.
Las cinco manadas crecieron un 16-21 % por nacimientos de crías durante el estudio (Cuadro D. La tasa anual de crecimiento sólo podrá determinarse cuando conozcamos la tasa anual de mortalidad por causas naturales, lo que requiere observaciones de largo plazo. Un factor imprevisible es el efecto que pueda tener la predación irregular y no selectiva por el hombre sobre la composición de las manadas. Suponiendo una completa protección de la predación por el hombre, podemos anticipar razonablemente una tasa de crecimiento por encima del 10%.
La proporción entre los machos y hembras reproductivas fue 1: 1,8, siendo el modo 1:2 (Cuadro D. Datos de nacimientos en cautiverio indican que la porporción entre sexos de crías nacidas es virtualmente 1:1 (Baldwin 1968,.Rosenblum 1972).
Cuadro 1.- Composición absoluta y porcentual
de 5 manadas de Saimiri sciureus Zona Norte.
A. Al comenzar la temporada de nacimientos
|
Manada Número |
Machos Adultos |
Hembras Adultas |
Juveniles |
Miembros Reproductivos | Proporción de Reproductivos |
| 14 | 2(10,5%) | 4(21,0%) | 13(68,4%) | 6(31,6%) | 1:2 |
| 15 | 3(12,5%) | 6(25,0%) | 15(62,5%) | 9(37,5%) | 1:2 |
| 16 | 3(13,0%) | 5(21,7%) | 15(65,2%) | 8(34,8%) | 1:1,7 |
| 17 | 2(12,5%) | 308,7%) | 11(68,7%) | 5(31,2%) | 1:1,5 |
| 18 | 203,2%) | 4(26,7%) | 09(60,0%) | 6(40,0%) | 1:2 |
|
X = 2,4(12,4%) |
4,4(22,7%) |
12,6(64,9%) |
6,8(35,0%) |
1:1,8 |
|
Manada |
Adultos |
Juveniles y |
Crías del año |
Incremento por cría |
| 14 | 6(27,3%) | 13(59,1%) | 303,6%) | 15,8% |
| 15 | 9(31,0%) | 15(51,7%) | 5(17,2%) | 20,8% |
| 16 | 8(29,6%) | 15(55,5%) | 404,8%) | 17,4% |
| 17 | 5(26,3%) | 11(57,9%) | 305,8%) | 18,7% |
| 18 | 6(33,3%) | 09(50,0%) | 306,7%) | 20,0% |
|
X = 6,8(29,6%) |
12,6(54,8%) |
3,605,6%) |
18,6% |
La desproporción observada entre los adultos reproductivos que posible mente es mayor (ver en hembras adultas) de lo encontrado por nosotros, es consecuencia de la diferencia en el desarrollo ontogénico; los machos entran a la fase reproductiva aproximadamente 2 a 3 años más tarde que las hembras (Baldwin 1969).
Densidad y tamaño estimado de la población.
La Fig. 4 muestra las áreas ocupadas por las manadas de Saimiri. Las manadas
del 1 al 19 (18 + 1 manadas) ocuparon una extensión continua de 7 km2 de
bosques, pequeñas chacras, cochas y caños. Esto excluye la zona
litoral del extremo nor-oriente de la isla, que consiste de terreno boscoso de
reciente formación (menos de 50 años) con una vegetación
sucesional y menos heterogénea que áreas de mayor madurez (Fig.
2).
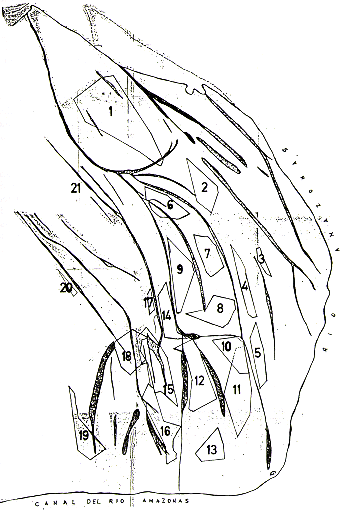
Fig. 4.- Distribución de las manadas de Saimiri sciureus
en el área de estudio. Los polígonos
indican las áreas qu las manadas ocuparon durante los períodos
de observación.
El presente delineamiento nos permite estimar la densidad ecológica en 2,6 0,1 manadas/km2 . lo que equivaldría, en término medio, a una manada por cada 39 ha. Basados en la densidad obtenida, podemos estimar la población total de la Zona Norte, como sigue: (33 km2 de área total - 7 km2 de faja litoral) x (2,6 + 0,1) = 67,6 + 2,6 = 65 - 70 manadas.
Considerando 20 individuos de locomoción propia como tamaño
promedio de las manadas, el número total estimado para el área
es de 1300 a 1400 individuos.
Censo por transectos.
Con fines comparativos, también llevamos a cabo 82 km de censo por transectos, con campo auditivo /visual de 100 m, desarrollado y aplicado por Freese (1975) para censos de Saimiri en tierra firme. El resultado fue 4,6 manadas/km2, que semeja a los resultados obtenidos con el mismo método en Setiembre 1975 (Soini, este volumen).
Nuestras experiencias con censos por transectos en la isla parecen indicar que, en el caso de Saimiri, este método tiende a dar una sobreestimación de la densidad poblacional. Aparentemente, esto no se debe al campo de detección que sería en realidad mayor de los 100 m (50 m por ambos lados de la trayectoria), pues la distancia de las manadas encontradas durante el censo oscilaba entre 0 y 50 m, con un promedio de 23 m del camino. Hay por lo menos dos factores que podrían desviar los resultados hacia densidades mayores :
La desigual utilización del terreno por los monos
dentro de su hábitat, alimentándose con mayor frecuencia en
las orillas de las cochas y caños (Fig.3).
La fragmentación temporal de las manadas en discretos subgrupos, que a menudo mantienen distancias mayores de 100 m entre sí, hace que cada subgrupo sea contado como manada. Asimismo, Janson (1975) censando en Cocha Cashu, Río Manú, encontraron que el censo de Saimiri por transectos resultó en una sobreestimación de la población y concluyeron que el ploteo de las manadas en mapa a base de censos simultáneos repetidos por transectos paralelos daban densidades más verídicas.
Area domiciliaria.
La extensión del área domiciliaria para 12 manadas fue estimada en base a nuestros conocimientos sobre los movimientos diarios y de los límites naturales circundantes. La extensión de las áreas oscilaba entre 15 y 54 ha, con un promedio de 30 ha (Cuadro 2).
Reproducción y desarrollo ontogénico.
Saimiri sciureus presenta un ciclo de reproducción anual y definido que aparentemente es regulado directa o indirectamente por factores meteorológicos como, por ejemplo, cambios estacionales de precipitación. En el Nor Oriente peruano, la t emporada de nacimientos empieza a fines de Diciembre y alcanza su máxima intensidad entre Enero y Febrero, y termina en Marzo (Dumond y Hutchinson 1967, Dumond 1968, Baldwin 1970, Rosenblum 1968; Soini, obs. pers.).
Cuadro 2.- Uso del espacio y el tamaño
de las areñas dorniciliarias de Saimiria scrureus en la Zona Norte.
| Manada N° | Días de Observación | Máxima extensión linear del área ocupada durante el período de observación (km) | Area ocupada durante el período de observación (ha) | Estimado tamaño mínimo del área domiciliaria (ha) |
| 1 | 11 | 1,35 | 54 | 54 |
| 2 | 3 | 0,75 | 12 | - |
| 3 | 5 | 0,40 | 02 | - |
| 4 | 6 | 1,00 | 03 | 35 |
| 5 | 10 | 0,09 | 09 | 25 |
| 6 | 9 | 0,65 | 12 | 20 |
| 7 | 7 | 0,60 | 13 | 30 |
| 8 | 6 | 0,65 | 12 | - |
| 9 | 11 | 0,95 | 17 | 40 |
| 10 | 7 | 0,65 | 12 | - |
| 11 | 10 | 1,15 | 24 | - |
| 12 | 8 | 0,90 | 19 | 35 |
| 13 | 3 | 0,50 | 9 | 25 |
| 14 | 11 | 0,75 | 11 | 15 |
| 15 | 17 | 1,10 | 20 | 30 |
| 16 | 18 | 1,05 | 15 | 23 |
| 17 | 4 | 0,35 | 2 | - |
| 18 | 14 | 0,60 | 14 | 23 |
| 19 | 10 | 0,95 | 12 | - |
| 20 | 2 | 0,40 | 2 | - |
| 21 | 1 | - | - | - |
El apareamiento se realiza en la temporada más seca, empezando en julio.y terminando en Setiembre. Para aquella temporada los machos maduros sufren cambios fisiológicos y etológicos, de origen hormonal, que se manifiestan en un visible engordamiento y en un cambio brusco de comportamiento hacia otros miembros de la manada (Dumond y Hutchinson 1967, Dumond 1968, Baldwin 1970, Rosenblum 1968, Nadler y Rosenblum 1972; Soini, obs. pers.).
La gestación dura aproximadamente 5,5 meses, siendo los valores externos reportados 152 y 172 días (Hopt 1967, Goss et al. 1968, Rosenblum 1968, Lorenz et al. 1973). Quince o 16 semanas antes del parto, la hembra empieza a aumentar de peso considerablemente y el abultamiento del vientre es igualmente discernible a plena vista unos 2 a 3 meses antes del parto. El alumbramientos se realiza generalmente de noche (Hopf 1967).
La cría es cargada en la espalda de la madre y no deja el cuerpo de su madre durante las 4 primeras semanas; en la quinta semana empieza a realizar breves excursiones de la espalda de su madre para explorar los alrededores. El proceso de separación y desmamantamiento ocurre a los 4 ó 5 meses, aproximadamente cuando la manada entra de nuevo a la temporada de aparcamiento y las interacciones de la madre con los machos adultos se intensifican. Aunque la cría de 5 meses ya es capaz de sobrevivir independiente dentro de la manada, la independización y desmamantamiento total se completa recién entre los 8 a 11 meses, generalmente alrededor de un mes antes que la manada entre nuevamente a la fase de cría (Baldwin 1968, 1969, 1970, 1971; Dumond 1968, Ploog et al. 1967, Long y Cooper 1968).
La hembra alcanza la madurez sexual durante el tercer año de vida y tiene su primera cría a los 3 años de edad. El macho alcanza su madurez sexual en la segunda mitad del tercer año de vida, pero entra al ciclo reproductivo de la manada generalmente recién a los 4,5-5 años de edad, cuando ha alcanzado la madurez social dentro de la jerarquía de la manada. (Baldwin 1968, 1969, 1970, 1971; Dumond 1968; Ploog et al. 1967). La Fig. 5 presenta un resumen gráfico del ciclo anual reproductivo y las Figs. 6 y 7 el desarrollo ontogénico de Saimiri.
En 6 manadas contiguas (Nos 14 al 19) se pudo constatar e nacimiento de crías. La falta de personal y la eventual inundación, y aislamiento de extensas áreas, no permitieron llevar a cabo observaciones simultáneas de crías en las otras manadas. Sin embargo, se constató la presencia de hembras preñadas en otras manadas entre Noviembre y Diciembre. La Fig. 8 indica las primeras fechas en que se constató la presencia de una o más crías recientemente nacidas en cada manada. En vista de la imposibilidad de observar simultáneamente toda la manada y reconocer individualmente todas las hembras, no fue posible registrar todos los nacimientos en una manada. La Fig. 8 también muestra las primeras fechas en que se observó hembras visiblemente preñadas. Por la naturaleza del estudio, la primera observación de la presencia de una o más crías en la manada no significa necesariamente que éstas nacieron en las fecha indicadas, aunque por el tamaño y comportamiento pudimos deducir que en la mayoría de los casos se trataba de crías de 1 a 15 días de edad y en ningún caso pasaban de un mes.
La primera cría del año se observó
el 22 de Enero, y su edad fue estimada en menos de 10 días. Los nacimientos,
a fines de Diciembre y primera mitad de Enero, no se observaron por no encontrarnos
en la isla en ese entonces, pero algunos lugareños nos informaron haber
visto crías muy pequeñas en aquel período.
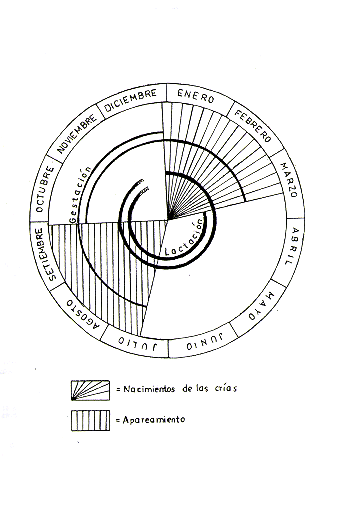
Fig. 5.- Presentación esquemática del ciclo anual reproductivo
de una manada de
Saimiri sciureus, basada en datos de Baldwin (1968, 1970, 1971) Dumond (1968),
Dumond y
Hutchinson (1967) y observaciones personales.
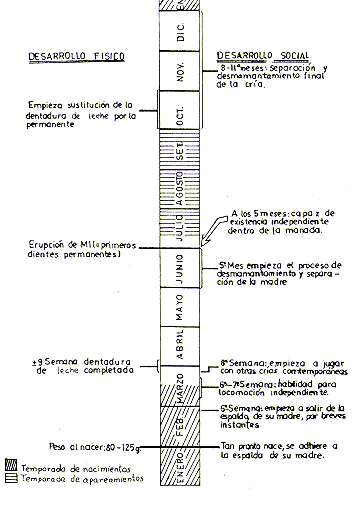
Fig. 6. - Cronología del desarrollo físico y social de
Saimiri sciureus en el primer año de vida,
según datos de Balwin (1969), Dumond (1968), Long y Cooper (1968), Ploog
rt al. (1967)
y observaciones personales. Fecha hopotética de nacimiento: 1 ded Febrero
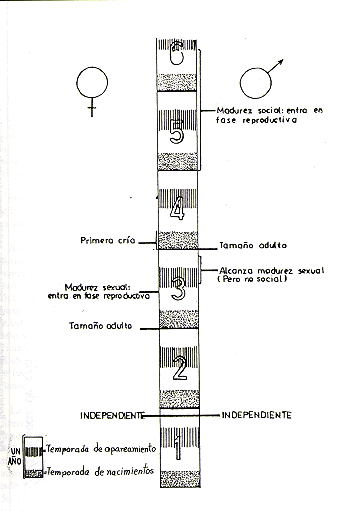
Fig.7. - Cronología del desarrollo
de Saimiri sciureus desde el nacimiento hasta la adultez, según
datos de Baldwin (1968, 1969, 1970), Dumond (1968) y Ploog et al. (1967)
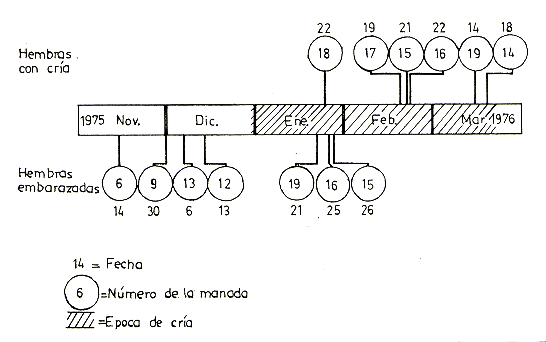
Fig. 8. - Registro de hembras preñadas y crías recíen
nacidas observadas
en la población de estudio de Saimiri sciureus.
En las cinco manadas estudiadas en detalle, el número
de crías nacidas oscilaba entre 3 y 5, a saber:
- Manada No 14 = 3 crías (Fecha del último conteo:
27.03.76)
- Manada N" 15 = 5 crías (Fecha del último conteo: 20.03.76)
- Manada NO 16 = 4 crías (Fecha del último conteo: 14.04.76)
- Manada No 17 = 3 crías (Fecha del último conteo: 07.03.76)
- Manada No 18 = 3 crías (Fecha del último conteo: 08.03.76)
También en la Manada No 19 vimos 2 crías, pero los conteos de la manada fueron incompletos y probablemente hubo más crías. Aunque las extensas inundaciones en la isla impidieron continuar las observaciones de manadas fuera de las fechas, es poco probable que hubieran más nacimientos después del último conteo, salvo en las Manadas Nos. 17 y 18.
Pese a la muestra pequeña, podemos concluir que la tasa de nacimientos de este año fue alrededor de 4 a 5 crías por manada, lo que permite estimar un total de 292 a 315 crías.
Actividad y uso del espacio diario.
La actividad diaria de Saimiri consiste de 13 horas aproximadamente. Los primeros individuos empiezan a moverse a las 05:30 h o un poco antes, cuando el bosque todavía está en oscuridad. Sin embargo, la manada no abandona su árbol de dormir hasta las 05:55 h en que se trasladan a otro árbol cercano para comer frutos. La mayor parte del día permanecen en constante locomoción, recorriendo la vegetación en busca de insectos y frutos. Al mediodía se observa un período más sedentario y de menor actividad. La manada entra al siguiente árbol de dormir alrededor de las 18:25 h, cuando el interior del bosque ya está oscuro. A las 18:45 h, la manada generalmente queda en completo silencio. En las noches de fuerte iluminación lunar, el subgrupo de machos juveniles o subadultos pueden seguir jugando y corriendo por las ramas, hasta las 19:00 h.
La ruta diaria de la manada consiste en una serie de recorridos a distintas direcciones, inclusive opuestas, pudiendo pasar dos o más veces por el mismo lugar o por el mismo árbol. El recorrido diario parece depender de la distribución temporal de los frutos y otros recursos alimentarios. A menudo la manada sigue la misma ruta por varios días consecutivos, visitando los mismos árboles frutales. Por ejemplo, un Ficus sp. en fructificación fue visitado por la misma manada durante ocho días consecutivos y generalmente dos o más veces por día. También observamos que las manadas por las tardes mostraban una marcada preferencia por el lado soleado de las riberas de cochas y caños.
Los valores obtenidos en el ploteo del recorrido
de un día completo de la Manada No 15, nos da una idea general del recorrido
diario de las manadas:
| Largo total del recorrido |
0,9 - 1,0 |
km |
| Máxima distancia linear del recorrido |
0,6 |
km |
| Distancia linear entre los sucesivos árboles de dormir. |
0,3 |
km |
| Area total abarcada (aproximada) |
6,0 - 6,5 |
ha |
El recorrido total fue ploteado a base de los movimientos generales del grupo principal de la manada y no incluye los zigzagueos menores. Estimamos que los individuos más móviles, especialmente los machos subadultos, tuvieron recorridos individuales mucho más largos.
Uso vertical del espacio.
Saimiri fue observado en todos los estratos verticales del bosque, desde el suelo hasta las copas de los árboles emergentes (30 m o más); sin embargo, con mayor frecuencia fue encontrado entre los 3 y 20 m sobre el suelo.
Arboles de dormir.
En 17 oportunidades, incluyendo seis diferentes manadas, pudimos observarlas en sus árboles de dormir, lo que permitió descubrir un patrón general en cuanto al uso y elección de los árboles. Las manadas durmieron cada noche en un árbol diferente, que distaba 150 a 300m del anterior. En una oportunidad, la Manada No 15 pasó la noche en un árbol donde había dormido hace 17 días antes. El subgrupo de machos a menudo pasaba la noche separado del grupo principal, a una distancia de hasta 30 a 40 m.
Los árboles de dormir presentaban las siguientes características:
Ubicación: En la orilla (o cerca de la orilla) de una cocha, caño o área.de vegetación baja (chacra, purma).
Tamaño. Grande o mediano (20 a 40m), con copa amplia y ramas grandes horizontales.
Relativa altura de la copa: Emergente o en el estrato superior.
Otras características: Follaje ralo, tronco limpio, sin sogas ni epífitas.
Estado reproductivo: Sin flores o frutos.
La especie de árbol utilizada con mayor frecuencia fue Clarisia biflora, pero también otras como Bombax aquaticum, Callycophyllum spruceanum, Ficus sp., y Scheelea sp.
Los animales durmieron acurrucados en pequeños grupos compactos sobre las partes medianas y distales de las ramas horizontales de la copa, generalmente entre 20 a 25 m de altura con respecto al suelo.
Alimentación y recursos alimentarios.
Saimiri sciureus es principalmente insectívoro y frugívoro. La proporción cuantitativa del consumo de insectos y frutos variaba de acuerdo con las fluctuaciones estacionales de la disponibilidad o abundancia de ciertos frutos. Así, por ejemplo, encontramos que entre Noviembre y Diciembre, época de menor abundancia de los frutos preferidos por Saimiri, las manadas "peinaban" con mayor frecuencia la vegetación arbustiva y semiarbustiva de las orillas de las cochas, caños y purmas, carente de frutos, pero supuestamente con mayor concentración de insectos. Por otro lado, entre Febrero y Marzo, época de abundancia de frutos de dos especies de Inga, encontramos a las manadas alimentándose con mayor frecuencia en aquellos árboles.
El Cuadro 3 indica las especies de cuyos frutos los Saimiri fueron observados alimentándose. Advertimos que el número de especies fue mucho mayor, pero por dificultades implícitas en conseguir muestras de los árboles y carencia de medios para la identificación taxonómica de las muestras colectadas no fue posible compilar una lista más exhaustiva.
Los árboles fueron clasificados en tres categorías principales, tomando como base el patrón de fructificación de la mayoría de los especímenes:
A. Arboles con un período definido y sincrónico de fructificación, es decir, aquellos que se cargan de frutos simultáneamente, resultando una superabundancia de éstos en una temporada definida. Entre estas especies figuran Inga spp., Clarisia biflora, Genipa americana, Rheedia macrophyla y Ogcodeia tamamuri.
B. Arboles de fructificación asincrónica, es decir, aquellos que se cargan de frutos individualmente en cualquier temporada del año. Entre esas especies figuran Pourouma sp., Ficus spp., Couepia sp., sacha guayaba y caimitillo.
C. Arboles de fructificación continua, aquellos que producen frutos en pequeñas cantidades durante todo o gran parte del año. Algunas especies que pertenecen a esta categoría son Artocarpus altilis y tamara de la restinga.
La Categoría A comprende los recursos estacionalmente fluctuantes, pero previsibles y temporalmente abundantes. Nuestras observaciones preliminares señalan dos períodos de máxima abundancia en esta categoría : Agosto a Setiembre, y Febrero a Marzo, estos períodos corresponden a las fases iniciales de embarazo y lactancia. La Categoría A, indudablemente, forma aparte el grueso del recurso alimentario vegetal para Saimiri. La Categoría B comprende los recursos imprevisibles, pero constantes o intermitentemente disponibles durante todo el año. La Categoría C comprende los recursos previsibles y constantemente disponibles en cantidades reducidas durante todo el año. Lo importante de estos recursos es que Saimiri pueda contar con ellos en las temporadas de baja producción de la Categoría A. Así, por ejemplo, observamos que hacia fines de Noviembre y en Diciembre hubo un período de marcada escasez de frutos, con cero abundancia de la Categoría A. Aparte de algunos árboles dispersos de la Categoría B, Saimiri dependía de los frutos de Artocarpus altilis y tamara de restinga, ambas pertenecientes a la Categoría C. Nuestra impresión es que Saimiri comía muy poco o nada de estos recursos durante la temporada de mayor abundancia de los otros frutos.
Cuadro 3.- Lista de árboles observados en fructificación
en la Isla de Iquitos durante un estudio anterior(Soini, este volumen) y el
presente estudio, con registro de la utilización observada de los frutos
por Saimiri sciureus.
|
X - |
Frutos maduros |
|
V - |
Frutos verdes |
|
M - |
Frutos superabundantes |
| O | Observación personal del consumo de los frutos por Saimiri. |
| Nombre vernacular | Nombre científico | Familia | E | F | M | A | M | J | J | A | S | O | N | D |
| Ayahuma | Couroupita | |||||||||||||
| amazónica | Lecythidaceae | X | ||||||||||||
| Calmítillo | Sapotaceae | X | ||||||||||||
| Cainúto | Lucuma caimito | Sapotaceae | X | |||||||||||
| Capinurí | Clarisia biflora | Moraceae | V | X | M | |||||||||
| Cetico | C-Opia sp. | Moraceae | X | |||||||||||
| Charichuelo (pequeño, liso) |
Rheedía macrophylla Guttiferae | Guttiferae | X | X | ||||||||||
| Charichuelo (grande, rugoso) |
Rheedia sp. |
Guttiferae |
X | |||||||||||
| Granadilla | Passiflara sp. | Passifloraceae | X | |||||||||||
| Guava(vana pequeña) | Inga edulis | Leguminosae | V | |||||||||||
| Guayaba | Psidium guayava | Myrtaceae | V | |||||||||||
| Huito | Genipa americana | Rubiaecae | X | X | V | |||||||||
| Lanza huayo | Psidium sp. | Myrtaceae | X | X | X | |||||||||
| Lupuna | Bombacaceae | |||||||||||||
| Macambo | Theobroma | |||||||||||||
| quinquenervia | Sterculiaceae | X | X | |||||||||||
| Mamey | Eugenia malacensis | Myrtaceae | X | |||||||||||
| Ñ-lilla | Bactris sp. | Palmae | X | |||||||||||
| Ojé | Ficus sp. | Moraceae | X | X | ||||||||||
| Pandisho | Artocarpus altilis | Moraceac | X | X | X | |||||||||
| Parinari | Couepia sp. | Rosaceae | X | |||||||||||
| Renaquillo | Ficus sp. | Moraceae | X | X | X | X | X | |||||||
| Sacha anona | Annona tessmanni | Annonaceae | ||||||||||||
| Sacha guayabo | Myrtaceae | X | ||||||||||||
| Taricaya | ||||||||||||||
| shimbillo | Inga sp."D" | Leguminosae | X | |||||||||||
| Shirribillo | Inga sp."A» | Legurninosae | X | X | ||||||||||
| Shimbillo | Inga sp.'B" | Leguminosae | X | X | ||||||||||
| Shimbillo | Inga sp."C" | Leguminosae | X | |||||||||||
| vaca marina | ||||||||||||||
| Tarnamurí | Ogcodeia tamamuri | Moraceae | X | |||||||||||
| Tarnara del bajo | Capparidaceae | V | X | X | ||||||||||
| Tarnara de la | ||||||||||||||
| restinga | Leonia glycicarpa | Violaceae | V | V | X | X | V | V | ||||||
| Uvilla | Pourouma | |||||||||||||
| cecropiaefolia | Moraceae | X | ||||||||||||
| Ubos | Spondias mombin | Anacarffiaceae | M | M | M | X | X | |||||||
| Uchu mullaca | ||||||||||||||
| Yacuruna huito | M | M | X | |||||||||||
| Shimbillo gordo | X | X | ||||||||||||
| Zapotillo | X |
Enfatizamos que nuestros conocimientos de la fenología y de la absoluta y relativa abundancia dejos recursos alimentarios en la isla para Saimiri son todavía preliminares y nuestras conclusiones tentativas.
Relaciones intraespecíficas.
Las manadas de Saimiri mostraron una fuerte tendencia a dividirse en subgrupos temporales que oscilaban desde individuos solitarios hasta unos 12 a 14 individuos. La relativa frecuencia de los diferentes subgrupos discretos observados fue (n=99):
1 macho solo 18,2%
2 machos adultos /subadultos 12,1%
3 a 5 machos juveniles y subadultos 22,2%
1 ó más hembras adultas acompañada (s) por juveniles 33,3%
otros 14,0%
La segregación más discreta fue entre el subgrupo de hembras con juveniles y el subgrupo de machos juveniles/ subadultos. Durante el recorrido diario, el subgrupo de hembras a menudo se movilizaba por delante y el subgrupo de machos por atrás, manteniendo una distancia fluctuante de unos 150 m del primero. Los machos adultos fueron observados solos, en pares o asociados con los machos juveniles. En muchos casos fue imposible distinguir los machos adultos de los subadultos.
La asociación más discreta y permanente
era la observada entre las hembras de la manada, acompañadas por infantes
y juveniles de las dos últimas temporadas de nacimientos. Dentro de este
grupo principal, las hembras lactantes andaban preferentemente en parejas, como
lo indican nuestras observaciones cuantitativas sobre.la relativa frecuencia
de las diferentes asociaciones dentro del grupo principal de la manada:
1 hembra con juveniles 39,4% 2 hembras con juveniles 51,5% 3 hembras con juveniles 9,1%
En los meses de Noviembre y Diciembre, pudimos observar un marcado aumento
en dispersión, y una consecuente disminución en cohesión
entre los subgrupos dentro de las manadas, la causa sería la escasez
de frutos en cantidades concentradas (cero abundancia de A) y consecuente cambio
de estrategia en la explotación del ambiente. Observaciones de otros
investigadores indican que el grado de cohesión dentro de la manada fluctúa
en sincronía con las fases del ciclo reproductivo, habiendo una mayor
cohesión en la temporada de apareamiento y mayor dispersión en
la temporada de gestación y cría (Baldwin 1968, 1969, 1970, 1971;
Baldwin y Baldwin 1972, Dumond 1968; Thorington 1967, 1968).
De las cinco manadas que tenían áreas domiciliarias parcialmente sobrepuestas, en ninguna observamos encuentros e interacciones directas. Entre dos a cuatro casos, encontramos miembros de manadas adyacentes alimentándose a una distancia de 40 a 60 m, pero las distancias entre las manadas se mantuvieron mayores.
Asociaciones con otras especies.
Del total de encuentros con manadas de Saimiri,
29% fueron halladas en asociación con bandadas de locreros (Crotophaga
major), aves gregarias, territoriales y abundantes en la isla, cuya alimentación
consiste de insectos, los que buscan en la vegetación baja de las orillas
de cochas, caños y purmas. La frecuencia de esta asociación mostró
una fluctuación temporal, como lo demuestran las observaciones cuantitativas
desde Diciembre hasta Marzo (n=143):
Diciembre
48%
Enero
23%
Febrero
23%
Marzo
6%
Las únicas interacciones detectadas entre los monos y las aves fue la tendencia de las aves a mantenerse cerca de los monos, mientras permanecían dentro de su territorio. La relación entre S. sciureus y C. major fue únicamente competitiva por la atracción mutua por el mismo recurso. Los insectos, al parecer, existen en mayor abundancia en la vegetación ribereña de las cochas, caños y purmas. La posibilidad de una relación simbiótica entre estas especies queda pendiente a una investigación más detenida. Las aves por su abundancia se convierten en el mayor competidor de Saimiri en cuanto a los recursos alimentarios de origen animal. La fluctuación en la asociación refleja en Saimiri el cambio de una dieta altamente insectívora (Diciembre) a una más frugívora, y la consecuente disminución de roce con los locreros.
En tres oportunidades, observamos que Saimiri estaba acompañado por parejas de tahuicuros (Monasa nigrifrons); estas aves al parecer capturaban los insectos que eran espantados por los monos.
Predatores.
La isla no tiene poblaciones de mamíferos mayormente predatores.
Entre los Falconiformes observados en la isla, ninguno mayormente es predator
de monos, salvo posibles incursiones desde tierra firme; el único predator
al parecer es el hombre.
Aotus nancymai
Estudios nocturnos fueron conducidos por un total de 73 horas. De los 32 encuentros nocturnos con manadas de Aotus, 20 a 23 fueron manadas diferentes. Aparte, durante el día, localizamos y observamos ocho manadas en sus respectivos árboles de dormir. La mayoría de estos árboles fueron chequeados periódicamente.
Durante los encuentros nocturnos, cuando las condiciones de observación lo permitían, registramos los siguientes datos básicos; hora y ubicación, modo de detección, distancia del primer animal detectado al observador y al camino, número total de animales, y tipo de bosque.
Los datos obtenidos (Cuadro 4) permiten establecer los parámetros para estimar densidades poblacionales mediante censos nocturnos por transectos. A continuación, examinamos brevemente las implicaciones y aplicaciones de algunos de éstos.
Modo de detección.
En los censos nocturnos, la detección inicial de Aotus es por medio del oído, ya sea 1) por el ruido de la vegetación durante los movimientos del animal y 2) por su vocalización característica. En este estudio, 74% de las detecciones fueron por vocalización y 26% por ruido. La detección por vocalización tiene la ventaja de ser específica e inconfundible, mientras que por ruido requiere confirmación vocal o visual, porque existe la posibilidad que haya sido producido por otro mamífero arbóreo. La vocalización de contacto y/o excitación emitida por Aotus con mucha frecuencia (por lo menos cuando el animal ha detectado la presencia del observador), es audible a unos 15 a 20 m, según la intensidad. Aparte de las comunicaciones vocales de corta distancia, Aotus emite ululidos de bajo tono, audibles a distancias mayores. Esta vocalización parecida al ululido de la lechuza ("Hoot" en la clasificación de Moynihan 1964), fue escuchado repetidamente entre las 19:20 h y 22:15 h durante los censos de Setiembre (Soini, este volumen), mas no en los censos de Febrero, Marzo y Abril. Desconocemos la función de estos ululidos, pero podría tratarse de animales solitarios en busca de pareja. Estos ululidos sirven para constatar la presencia de Aotus, pero no son utilizables para determinar las densidades poblacionales, pues las distancias al animal no pueden ser determinadas (los desplazamientos irregulares del animal vocalizante excluyen la posibilidad de su localización por triangulación), como tampoco la proporción de individuos de la población total que vocalizan.
Cuadro 4.- Registros nocturnos de Aotus sp. en la Zona Norte
| Fecha |
Hora |
Número de Individuos |
Modo de Detección |
Altura de Animal |
Hábitat* |
Distancia de Detección |
|
06.11.75 |
09:55 |
(1) |
Auditiva |
- |
- |
No determinada |
|
06.11.75 |
20:05 |
(1) |
Auditiva |
- |
- |
No determinada |
|
06.11.75 |
22:03 |
(1) |
Auditiva |
- |
- |
No determinada |
|
11.11.75 |
19:23 |
(1) |
Auditiva |
- |
- |
No determinada |
|
11.11.75 |
21:00 |
(1) |
Auditiva |
- |
- |
No determinada |
|
26.02.76 |
18:55 |
2 |
Auditiva |
10m |
Tahuampa con bosque alto |
10m |
|
27.02.76 |
19:00 | 3 | Auditiva | - | .Restinga con
bosque alto |
.
6m |
|
27.02.76 |
19:45 |
1-2 |
Auditiva |
5m | .
Orilla chacra |
.- |
|
05.03.76 |
19:50 |
Voces |
Auditiva |
- | .
Tahuampa con bosque alto |
.
20m |
|
05.03.76 |
20:28 |
2 |
Auditiva |
- | .- | - |
|
07.03.76 |
18:35 |
2-3 |
Auditiva |
- | .
Orilla caño |
15 m |
|
08.03.76 |
05:20 |
1-2 |
Auditiva |
- | .
Orilla caño |
15 m |
|
12.03.76 |
05:20 |
2 |
Auditiva |
- | .
Tahuampa con bosque alto |
|
|
15.03.76 |
05:13 |
1-2 |
Auditiva |
- | .
Tahuampa con bosque alto |
20 m |
|
15.03.76 |
05:32 |
2 |
- |
- | .
- |
60 m |
|
16.03.76 |
19:15 |
Voces |
- | - | .
Orilla caño |
- |
|
19.03.76 |
18:30 |
2 |
Auditiva |
- | .
Orilla caño |
50 m |
|
20.03.76 |
18:10 | 2 |
Auditiva |
3-4 m | .
Orilla chacra |
5 m |
|
26.03.76 |
05:40 |
3 |
Auditiva |
- | .
Orilla caño
|
10 m |
|
27.03.76 |
05:10 |
2 |
Auditiva |
5 m | .
Orilla caño |
10 m |
|
27.03.76 |
18:18 |
2 |
Auditiva |
10-15m |
.
Restinga con bosque alto |
|
|
30.03.76 |
18:30 |
2 |
Auditiva |
15 m | .
bosque alto |
20 m |
|
01.04.76 |
18:25 |
2 |
Auditiva |
3 m | .
Orilla purma |
10 m |
|
01.04.76 |
18:40 |
Voces |
Auditiva |
10-15 m | .
Orilla cocha |
30 m |
| 04.04.76 | 18:20 |
2 |
Auditiva |
5 m | .
Orilla purma |
15 m |
| 05.04.76 | 18:20 | 3 |
Auditiva |
30 m | ||
|
06.04.76 |
18:20 | 3 |
Auditiva |
3-4 m |
Orilla purma |
- |
|
10.04.76 |
18:13 | 3 |
Auditiva |
4m |
Orilla purma |
- |
|
10.04.76 |
18:57 | - |
Auditiva |
5-10 m |
Orilla cocha |
10 m |
|
17.04.76 |
18:08 | 3 |
Auditiva |
10 m |
- | - |
|
17.04.76 |
19:00 |
Voces |
Auditiva |
- |
Orilla purma |
20 m |
|
* |
Tahuampa |
= |
Bosque de inundación |
|||
|
Restinga |
= |
Terrenos más elevados, 961o ocasionalmente inundado |
||||
|
Chacra |
= |
Sembrado |
||||
|
Purma |
= |
Sembrados abandonados de vegetación secundaria |
||||
|
Cocha |
= |
laco o lastuna |
||||
Distancia de detección.
La distancia del animal al observador en el instante de la detección inicial osciló entre 6 y 60 m. Sin embargo, la distancia lateral fue de 0 a 20 m (80% de los casos en que pudo ser determinada). Estos datos más las observaciones fuera de censo, señalan en 20 m como la máxima distancia perpendicular detectable de los individuos; en otras palabras, para el cálculo de densidad poblacional consideramos en 40 m "el campo de 100% de detectabilidad" y excluimos del cálculo toda manada observada a distancias mayores de 20 m del camino.
Altura sobre el suelo.
Los animales fueron observados desde 3 a 15 m sobre el suelo, pero la mayoría estuvo alimentándose a niveles bajos, generalmente entre 3 y 5 m de altura.
Tamaño y composición de las manadas.
Para determinar el número exacto de individuos en una manada fue necesario ubicarlos y contar con ayuda de una linterna y binocular, que muchas veces resultó factible debido al reducido tamaño de las manadas y la buena cohesión entre los individuos dentro de ella. Sin embargo, constatar la presencia de crías sin locomoción es más difícil y requiere óptimas condiciones de observación. Las unidades sociales contenían desde 1 a 3 individuos (Cuadros 4 y 5). Las manadas de 3 individuos estaban compuestas por la pareja adulta y su cría.
Hábitat
Aotus fue encontrado habitando los bosques primario y secundario heterogéneos, tanto en zonas inundables (bajiales)como en terrenos más altos (restingas). La ubicación de los árboles madriguera y los encuentros nocturnos indicaron una preferencia por las orillas de las cochas, chacras y purmas (Cuadro 5 y Fig. 9).
Censos por transectos.
Los censos fueron conducidos en 29 noches, por un tiempo total de 36:25 h, habiendo reconocido 35 km e incluyendo censos repetidos. Las observaciones fuera de censo indicaron que Aotus iniciaba sus actividades a las 18:10 h y finalizaba con el retorno a su madriguera alrededor de las 05.40 h de la madrugada. Con estos criterios, los censos fueron conducidos desde las 04:30 h a 05:30 h de la madrugada y desde las 18:10 h a 20.00 h, y ocasionalmente hasta las 23:00 h. El censo consistía en avanzar a una velocidad de 1 km/h y con frecuentes paradas a través de una trocha más o menos recta y registrar todos los individuos o manadas detectadas a lo largo de los transectos.
Cuadro 5.- Registros mensuales de uso de madrigueras (huecos en troncos de árboles) por Aotus nancymai en la Zona Norte. Las cifras indican los meses en que cada madriguera fue observada y el número de cohabitantes encontrados ( V = la madriguera abandonada .
| Manada N° | Especie de árbol | Altura del Hueco de Entrada |
Ubicación | S | 0 | N | D | E |
F |
M |
A |
| 1 | Erythrina sp. | 25 m | Orilla de cocha y pungal | 3 | 3 | ||||||
| 2 | a) Erythrina sp. | 10 m | Restinga de bosque alto |
|
2 | 2 | V | ||||
| b) Flcus sp. | 11 m | - | |||||||||
| 3 | Ficus sp. | 12 m | Orilla de purma | 3 | V | ||||||
| 4 | calycophyllum spruceanum | 25 m | Orilla de cocha | 3 | 3 | V | V | ||||
| 5 | clarisia biflora | 20 m | Orilla de purma | 1 | 2 | 2 | V | ||||
| 6 | Indeterminado | - | Orilla de caño | 3 | |||||||
| 7 | Indeterminado | - | Orilla de purma | 3 | |||||||
| 8 | calycophyItum spruceanum | - | Orilla de cocha | 2 | |||||||
| 9 | calycophyItum spruceanum | 22 m | Restinga de bosque alto | 3 | |||||||
* Observaciones hechas durante el estudio anterior en la Isla
(Soini, este volumen).
Resultados del censo por transecto. Se constató
la presencia de Aotus en seis transectos. Sin embargo, la densidad fue calculada
solamente para tres transectos, los obtenidos en los otros tres consistieron
únicamente de vocalizaciones (ululidos) no computables. Los resultados
dieron las siguientes densidades :
|
Distancia única |
Veces censada |
Manadas/km |
Manada/km2 |
|
|
Transecto B |
1480 m |
8 noches |
0,17 |
4,2 |
|
Transecto E |
1580 m |
2 noches |
0,63 |
15,7 |
|
Transecto F |
761 m |
8 noches |
0,98 |
24,5 |
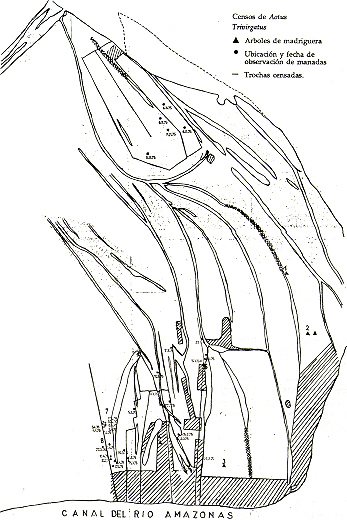
Fig. 9.- Ubicaciones de las manadas y árboles de madrigueras
de Aotus nancymai
observadas en el área de estudio
La alta densidad obtenida en el Transecto 'T" indudablemente sobreestima la densidad verdadera, debido a lo corto del transecto. Las dos manadas encontradas repetidamente a lo largo del transecto se ubican siempre alrededor de los extremos opuestos del transecto, lo que en realidad viene a representar la distancia linear entre ambas manadas. Este tipo de desvío puede ser eliminado utilizando transectos más largos (mayores de 2 km) que indudablemente darían resultados más próximos a la realidad. Las densidades obtenidas en los Transectos "B" y "E" darían como promedio 10 manadas/km2 , que probablemente está más cerca a la verdadera.
El ploteo de los encuentros nocturnos y las ubicaciones de los árboles-madriguera, revelan que dentro de una extensión de 1,3 km2, tenemos un mínimo de 12 manadas diferentes, es decir, 9 manadas / km2. Sin embargo, desconocemos el máximo número de manadas que utilizan parte de esta extensión, así como la extensión total ocupada por las manadas dentro de la citada extensión.
Las dos estimaciones de la densidad poblacional reportan resultados muy semejantes entre sí y probablemente no muy lejos de la verdadera densidad de Aotus en la isla. No obstante, la presente estimación debe ser considerada solamente preliminar, pendiente de nuevos censos y observaciones adicionales en la isla.
CONCLUSIONES
Saimiri sciureus
1. El hábitat de Saimiri en la Zona Norte de la Isla de Iquitos consiste en bosque primario y/o secundario heterogéneo. Las orillas e inmediaciones de las cochas y caños son áreas de mayor importancia para las manadas.
2. El área tiene una densidad ecológica de 2,6+ 0,1 manadas de Saimiri por km2 y una población total estimada de 65-70 manadas.
3. El tamaño de las áreas domiciliarias de las manadas oscila entre 15 y 54 ha.
4. El tamaño promedio de las manadas es 20 individuos de locomoción propia, lo que daría una población total de 1300 a 1400 individuos para la Zona Norte.
5. El incremento de la población por nacimientos de Enero a Marzo fue de 16 a 21%. Bajo una protección completa, podemos anticipar una tasa de crecimiento poblacional anual mayor a 10%.
6. Aproximadamente 1/3 de la población está formada por animales reproductivos y 2/3 de inmaduros. La proporción entre machos reproductivos y hembras reproductivas es aproximadamente 1:2.
7. Saimiri tiene un ciclo de reproducción anual definido con nacimientos desde Enero a Marzo y apareamientos desde Julio a Setiembre.
8. La proporción cuantitativa del consumo de insectos está en función a la abundancia o escasez de ciertos frutos. Entre Noviembre y Diciembre hay marcada escasez de frutos, lo que podría ser factor limitante eventual para el crecimiento de la población de Saimiri en la isla.
9. Crotophaga major es el mejor competidor de Saimiri por los recursos de origen animal.
10. Exceptuando al hombre, en la isla no existen otros predatores para Saimiri.
Aotus nancymai.
1. La densidad poblacional puede ser estimada mediante censos nocturnos por transectos.
2. Para una mayor confiabilidad, los transectos deben superar longitudes mayores de 1,5 km y recorrerlos repetidamente. Los censos no deben efectuarse antes de las 18:10 h ni después de las 05:30 h.
3. El campo auditivo/visual con 100% de detectabilidad fue estimado en 40 m, es decir 20 m por cada lado del transecto.
4. El censo preliminar de Aotus en la Zona Norte de la Isla de Iquitos reportó una densidad ecológica de 10 manadas/km2.
5. Una manada estuvo integrada hasta por 4 individuos, es decir la pareja reproductiva y su progenie, aunque también se observó animales solitarios.
REFERENCIAS
Baldwin, J. D. 1968. The social behavior of adult male squirrel monkeys (Saimiri sciureus)in a seminatural environment. Folia Primatol. 9:281 -314.
Baldwin, J. D. 1969. The ontogeny of social behavior of squirrel monkeys (Saimiri sciureus) in a seminatural environment. Folia Primatol. 11:35 -79.
Baldwin, J. 1970. Reproductive synchronization in squirrel monkeys (Saimiri). Primates 11: 317 - 326.
Baldwin, J. D. 1971. The social organization of a semifree-ranging troop of squirrel monkeys (Saimiri sciureus). Folia Primatol. 14:23 -50
Baldwin, J. D. y J. I. Baldwin. 1972. The ecology and behavior of squirrel monkeys (Saimiri oerstedi) in a natural forest in western Panama. Folia Primatol. 18:161 -184.
Dumond, F. 1968. The squirrel monkey in a seminatural environment. pp. 87-145. En L. A. Rosenblum y R. W. Cooper (Eds.). The Squirrel Monkey.-Academic Press, New York.
Dumond, F. y T. Hutchinson. 1967. Squirrel monkey reproduction: The "fatted" male phenomenon and seasonal spermatogenesis. Science 158: 1067 - 1070.
Freese, C. 1975. A census of nonhuman primates in Peru. Report to the OPS, and National Academy of Science. 25 Pp.
Goss, C., L. Popejoy II,J. Fusiler y T. Smith. 1968. The squirrel monkey. pp. 171- 191. Academic Press, New York.
Hopf, S. 1967. Notes en pregnancy, delivery, and infant survival in captive squirrel monkey. Primates 8:323 - 332.
Janson, C. 1975. Ecology and population densities of primates in a Peruvian Rainforest. Tesis Bachiller, Dept. of Biology, Princeton University, Princeton, NJ.
Long, J. 0. y R. W. Cooper. 1968. Physical growth and dental eruption in captive-bred squirrel monkeys Saimiri sciureus (Leticia, Colombia). pp 193 -205. En L. A. Rosenblum y R.W. Cooper (Eds.). The Squirrel Monkey. Academic Press, New York.
Lorenz, R., C. Anderson y W. Manson. 1973.
Notes en reproduction in captive squirrel. monkeys. Folia Primatol. 19286 -292.
Moynihan, M. 1964. Some behavior patterns of Platyrrhine monkeys. 1. The night monkey (Aotus trivirgatus) Smithsonian Miscell. Coll. 146 (5):1-84.
Nadler, R. y L. Rosenblum. 1972. Hormonal regulation of the "fatted" phenomenon in squirrel monkeys. Anat. Rec. 173:181 -188.
Ploog, D., S. Hopf y P. Winter. 1967. Ontogenese des verhaltens von totenkopf-aften (Saimiri sciureus). Psychol. Forsch. 31: 1-41.
Rosenblum, L. 1968. The squirrel monkey. pp 147 - 169. Academic Press, New York.
Rosenblum, L. 1972. Breeding Primates. pp 130-143. Karger, Basel.
Soini, P. (este volumen). Resultados de una investigación preliminar de la fauna en las Islas de Iquitos e islas adyacentes.
Thorington, R.W., Jr. 1967. Feeding and activity of Cebus and Saimiri in a Colombian forest. pp. 180 - 184. En D. Starck, R. Schneider y H. J. Kuhn (Eds.). Neue Ergelm. Primatol. G. F. Verlag, Stuttgart.
Thorington, R. W., Jr. 1968. Observations of squirrel monkeys
in a Colombian forest. pp. 69-85. En L. A. Rosenblum y R. W. Cooper (Eds.).
The Squirrel Monkey. Academic Press, New York.

